
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是 ( )

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c、d、e四种元素中都存在能促进水的电离的含氧酸盐
D. e和其它四种元素均能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5min后,电极5的质量增加2.16g。假设电解过程中溶液的体积不变。

请回答下列问题:
(1)电源中a是_______极。A池中阳极的电极反应式为___________,C池中阴极的电极反应式为___________________________。
(2)通电5min后,如果B槽中共收集到224mL气体(标准状况),且溶液体积为200mL,则通电前溶液中Cu2+的物质的量浓度为___________________。
(3)如果A池溶液是200mL食盐水(假设电解液足量),则通电5min后,溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体分子且键角都为109°28′
C. NaCl晶体中与每个Na+距离相等且最近的Na+共有8个
D. 单质的晶体中一定不存在的微粒是阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂就可以鉴别①NaOH;②H2SO4;③CuSO4;④NaCl四种物质的溶液,则最先鉴别出来的物质是( )
A.①B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。

(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
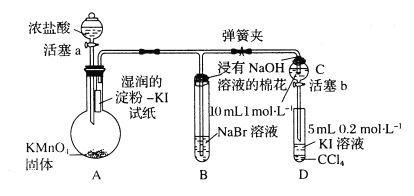
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。下列说法正确的是

A. 化合物甲中的含氧官能团有羰基和酯基
B. 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙
C. 化合物乙不能发生消去反应
D. 化合物丙能和FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写中正确的是
A.氢氧化铁与盐酸反应:H++OH-=H2O
B.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.氧化铜溶于稀硫酸:CuO+2H+=Cu2++H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com