
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。

(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
【答案】 [Ar] 3d104s2 CO2 直线形 氢键 6 面心立方最密堆积 CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量 6
【解析】(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形.故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线形;
(2)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石,故答案为:氢键;
(3)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6,Ca2+采取的堆积方式为面心立方最密堆积,O2-处于Ca2+堆积形成的八面体空隙中;晶格能大小与离子带电量成正比,CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,故答案为:6;面心立方最密堆积;CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量;
(4) CN-是常见的配位体,在配位化合物K3[Fe(CN)n]中每个配体可以提供2个电子,而铁原子最外层有2个电子,根据铁原子的最外层电子数和配体提供电子数之和为14,可得2+2n=14,所以n=6,故答案为:6。


科目:高中化学 来源: 题型:
【题目】1,4﹣戊二烯和X是有机合成的基础原料,用下列方法可以合成F如图1. 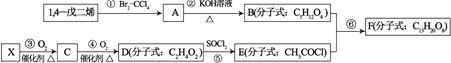
(1)已知C与新制的氢氧化铜共热生成红色沉淀;X是分子中所有原子共平面的烃.则X的结构简式为 , X在一定条件下生成的高分子化合物的结构简式为 .
(2)①的反应类型是 , F中所含官能团的名称是 .
(3)1,4﹣戊二烯最多共面的碳原子数为 , 它的一种同分异构体为 ![]() ,该有机物的系统命名为 .
,该有机物的系统命名为 .
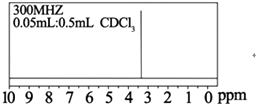
(4)与B互为同分异构体的T是有机合成的中间体,它的核磁共振氢谱如图2所示.则T的结构简式为 .
(5)反应②的化学方程式为 , 反应⑤生成物中除水外的无机物的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶 液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请根据要求回答:
(1)②组情况表明,c________ (选填“大于”、“小于”或“等于”)0.2。混合液中离子浓度c(A-)与c(Na+)的大小关系是______________________________________。
(2)从③组实验结果分析,说明HA的电离程度________(选填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_____________________________。
(3)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。写出该混合溶液中下列算式的结果(不能作近似计算)。c(Na+)-c(A-)=________mol·L-1; c(OH-)-c(HA)=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mL
B.45mL
C.30mL
D.15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A,B,C,D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( ) 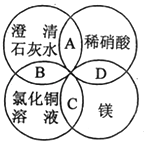
A.OH﹣+HNO3═H2O+NO ![]()
B.Ca(OH)2+Cu2+═Ca2++Cu(OH)2
C.Mg+Cu2+═Cu+Mg2+
D.Mg+2H+=Mg2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电池的正极材料,可通过下列方法制得:①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80℃恒温加热24ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以100℃预处理6h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是(用离子方程式表示)
(2)步骤②的反应瓶材质可能是(填序号)
A.玻璃
B.陶瓷
C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为
(4)从安全的角度考虑,在实验室里制三氟化铁时应在中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反应的化学方程式为
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C12 , Fe2+恰好被完全氧化成Fe3+ , 然后把溶液蒸干,灼烧至恒重得9.6g固体,则该铁氧体的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1mol?L﹣1的NaOH溶液中:K+、Na+、SO ![]() 、CO
、CO ![]()
B.0.1mol?L﹣1的Na2CO3溶液中:K+、Ba2+、NO ![]() 、Cl﹣
、Cl﹣
C.0.1mol?L﹣1的FeCl3溶液中:K+NH ![]() 、I﹣、SCN﹣
、I﹣、SCN﹣
D.0.1mol?L﹣1的盐酸中:Fe2+、Na+、Br﹣、NO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:2A(g)+B(g) ![]() 2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的物质的量是反应前的5/6.
2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的物质的量是反应前的5/6.
(1)达到平衡时,C的物质的量浓度_________________
(2)达到平衡时,A的转化率___________________。
(3)达到平衡时,用物质B表示的化学反应速率为__________________。
(4)已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,某时刻在容积固定的容器中测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,某时刻在容积固定的容器中测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.43 | 0.4 | 0.4 |
比较此时正、逆反应速率的大小:v(正)____v(逆)(填“>”、“<”或“=”),若上述反应达到平衡时c(CH3OH)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com