
【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mL
B.45mL
C.30mL
D.15mL
【答案】A
【解析】解:完全生成HNO3 , 则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了
根据得失电子守恒:n(Cu)×2=n(O2)×4
n(Cu)×2= ![]() mol×4
mol×4
n(Cu)=0.15mol
所以 Cu(NO3)2 为0.15mol
根据 Cu2+~2OH﹣
0.15mol n(OH﹣)
则NaOH 为 0.15mol×2=0.3 mol
则NaOH 体积V= ![]() =
= ![]() =0.06L,即 60 mL,
=0.06L,即 60 mL,
故选A.
根据电子得失守恒,求出参加反应的铜,然后求出 Cu(NO3)2 , 再根据 Cu(NO3)2与NaOH 反应的关系,求出NaOH 的物质的量,最终求出NaOH溶液的体积.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转. 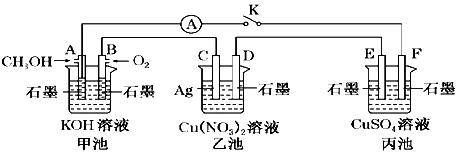
请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为 .
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为 .
(3)当乙池中C极质量减轻4.32g时,甲池中B电极理论上消耗O2的体积为mL(标准状况).
(4)一段时间后,断开电键K.下列物质能使乙池恢复到反应前浓度的是(填字母).
A.Cu
B.CuO
C.Cu(OH)2
D.Cu2(OH)2CO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化工原料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害,某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源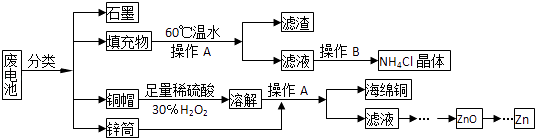
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示).铜帽溶解完全后,可采用方法除去溶液中过量的H2O2 .
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.①当1molMnO2参加反应时,整个反应共有mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1molL﹣1 NH4NO3溶液中的氮原子数为0.1NA
B.22g N2O所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.将足量铜加入54.3mL 18.4 molL﹣1浓H2SO4中充分反应产生气体的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是( )
A.先加Cl2 , 再加Br2
B.先加Cl2 , 再加HBr
C.先加HCl,再加HBr
D.先加HCl,再加Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。

(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系.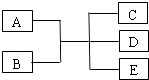
(1)若A是一种红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是 , B在反应中表现出的性质是、 .
(2)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式;实验室检验C的方法 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com