
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶 液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请根据要求回答:
(1)②组情况表明,c________ (选填“大于”、“小于”或“等于”)0.2。混合液中离子浓度c(A-)与c(Na+)的大小关系是______________________________________。
(2)从③组实验结果分析,说明HA的电离程度________(选填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_____________________________。
(3)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。写出该混合溶液中下列算式的结果(不能作近似计算)。c(Na+)-c(A-)=________mol·L-1; c(OH-)-c(HA)=________mol·L-1。
【答案】 大于 c(A-)=c(Na+) 大于 c(A-)>c(Na+)>c(H+)>c(OH-) 105 105-109 109
【解析】(1)常温下,一元酸HA和NaOH溶液等体积混合,由①可知:两种溶液的物质的量浓度都为0.1mol/L,则酸碱的物质的量相等,反应后pH=9,说明反应后溶液呈碱性,则HA是弱酸,②中两溶液的等体积混合pH=7(),说明溶液呈中性,故②组中c大于0.2,根据电荷守恒c(A-)+c(OH-)=c(Na+)+ c(H+),溶液呈中性,即c(OH-)=c(H+),可得c(A-)=c(Na+);(2)③组反应后溶液中含有等物质的量的HA、NaA,因反应后溶液的pH<7,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,故混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-);(3)①组溶液的pH=9,则氢离子浓度为10-9mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=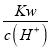 =
=![]() =10-5mol/L,一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),依据上述计算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=10-5-10-9;依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=c(A-)+c(HA),合并得到c(OH-)-c(HA)=c(H+)=10-9。
=10-5mol/L,一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),依据上述计算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=10-5-10-9;依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=c(A-)+c(HA),合并得到c(OH-)-c(HA)=c(H+)=10-9。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.0.1molL﹣1的NaCl溶液中,Na+与Cl﹣离子总数为0.2NA
B.标准状况下,2.24L水的质量是1.8g
C.16gO3比16gO2所含的氧原子数多
D.22gCO2与标准状况下11.2L Cl2含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
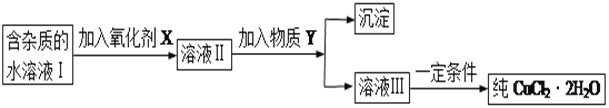
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化工原料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验室从化学试剂商店买回18.4molL﹣1的硫酸.现用该浓硫酸配制100mL 1molL﹣1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有(选填序号),还缺少的仪器有(写仪器名称).
(2)配制100mL 1molL﹣1的稀硫酸需要用量筒量取上述浓硫酸的mL(保留一位小数).
(3)实验中造成所配溶液浓度偏高的原因可能是 .
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害,某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源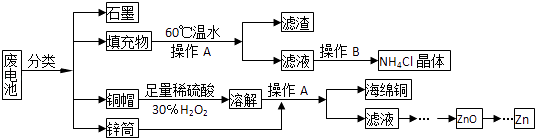
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示).铜帽溶解完全后,可采用方法除去溶液中过量的H2O2 .
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.①当1molMnO2参加反应时,整个反应共有mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1molL﹣1 NH4NO3溶液中的氮原子数为0.1NA
B.22g N2O所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.将足量铜加入54.3mL 18.4 molL﹣1浓H2SO4中充分反应产生气体的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。

(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铁粉反应放出大量氢气,此溶液中可能大量共存的离子组是( )
A.H+、K+、Mg2+、Cl﹣
B.Ba2+、SO ![]() 、Cl﹣、OH﹣
、Cl﹣、OH﹣
C.K+、OH﹣、CO ![]() 、MnO
、MnO ![]() ?
?
D.Ca2+、H+、Cl﹣、HCO ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com