
����Ŀ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵����18.4molL��1�����ᣮ���ø�Ũ��������100mL 1molL��1��ϡ���ᣮ�ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ�����ƿ�����ձ�����ҩ�ף�����Ͳ����������ƽ����ش��������⣺
��1������ϡ����ʱ�����������в���Ҫʹ�õ�����ѡ����ţ�����ȱ�ٵ���������д�������ƣ���
��2������100mL 1molL��1��ϡ������Ҫ����Ͳ��ȡ����Ũ�����mL������һλС������
��3��ʵ�������������ҺŨ��ƫ�ߵ�ԭ������� ��
A.����ƿ��ԭ��������������ˮ
B.δ����ȴ������ת��������ƿ��ϴ���ձ�������
C.�ձ�û��ϴ��
D.������ƿ�м�ˮ����ʱ�۾�һֱ���ӿ̶��ߣ�
���𰸡�
��1���ڢܢޣ�100mL����ƿ��������
��2��5.4
��3��B
���������⣺��1�����������м��㡢��ȡ��ϡ�͡���Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ���������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ��ò��������裬��ȴ��ת�Ƶ�100mL����ƿ�У����ò�����������ϴ��2��3�Σ���ϴ��Һת�Ƶ�����ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ����ṩ��������֪����Ҫ�������У�����ƿ����ҩ�ף���������ƽ������Ҫ�����У�100mL����ƿ�����������ʴ�Ϊ���ڢܢޣ�100mL����ƿ������������2������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬������Ũ������������Ũ��������ΪxmL�����У�xmL��18.4mol/L=100mL��1mol/L����ã�x��5.4���ʴ�Ϊ��5.4����3��A������ƿ��ԭ��������������ˮ������Һ�������Ӱ�죬��������ҺŨ�Ȳ��䣬��A���� B��δ����ȴ������ת��������ƿ��ϴ���ձ����ȵ���Һ���ƫ����ȴ����Һ�����С���������Ƶ���Һ���ƫС����������ҺŨ��ƫ��B��ȷ��C���ձ�û��ϴ�ӣ��������Ƶ���Һ�����ʵ����ʵ���ƫС����������ҺŨ��ƫС����C����D��������ƿ�м�ˮ����ʱ�۾�һֱ���ӿ̶��ߣ�Һ�泬���̶��ߣ���Һ�����ƫ����������ҺŨ��ƫС����D���ʴ�Ϊ��B����1������������Һ��ʵ���������ѡ��������������жϣ���2���ٸ�����Һϡ��ǰ�����ʵ��������������Ũ������������3�������������������ʵ�������Һ�����Ӱ�죬����c= ![]() �ж϶���ҺŨ�ȵ�Ӱ�죮
�ж϶���ҺŨ�ȵ�Ӱ�죮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ƚϲ���ȷ���� ( )
A. ���ˮ��Ӧ��������ˮ��Ӧ����
B. �����Li��Na��K���ʶ�����O2��ȼ�����ɹ�������
C. �ۡ��е�:Li>Na>K
D. ����:LiOH<NaOH<KOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮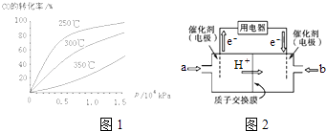
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ����ʽΪ �� ���÷�Ӧ6NO2+8NH3 ![]() 7N2+12H2OҲ���Դ���NO2 �� ��ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2+12H2OҲ���Դ���NO2 �� ��ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
��2����֪��
2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1
2NO ��g��+O2��g��2NO2��g����H=��113.0kJmol��1
��ӦNO2��g��+SO2��g��SO3��g��+NO ��g�� �ġ�H=kJmol��1 �� һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1mol SO3��ͬʱ����1mol NO2
���������Ӧƽ��ʱ��NO2��SO2�����Ϊ1��6����ƽ�ⳣ��K= ��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO ��g��+2H2��g��CH3OH ��g����
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ1��ʾ���÷�Ӧ��H0���������������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��
�ڼ״�ȼ�ϵ�أ����DMFC�����ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ����ͼ2��ʾ��ͨ��a����ĵ缫��ԭ��ص��������������������缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ�в���ȷ���ǣ� ��
A.H2SO4�T2H++SO ![]()
B.Ba��OH��2�TBa2++2OH��
C.NaNO3�TNa++NO ![]()
D.KClO3�TK++Cl��+3O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�����ϸ�����л��ʵĴ�������������ѧ�ҿ�����������ȼ�ϵ�أ���װ����ͼ��a��bΪ���Ե缫�����ø�װ�ý���ˮ�е��л����C6H12O6Ϊ��������������ȥ���Ӷ��ﵽ����ˮ��Ŀ�ģ�����˵������ȷ���ǣ� �� 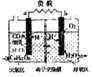
A.a�缫��ӦʽΪ��C6H12O6+6H2O��24e���T6CO2+24H+
B.��Ӧ�����в����������������ӽ���Ĥ��ɢ��������
C.�������Ҳ�缫�������غ��������缫
D.�����£��øõ�ص��һ�����ı�������ͭ��Һ���缫Ϊ���Ե缫��������ˮ�ĵ���ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±���
ʵ���� | HA���ʵ��� Ũ��(mol��L��1) | NaOH���ʵ��� Ũ��(mol��L��1) | ����� Һ��pH |
�� | 0.1 | 0.1 | pH��9 |
�� | c | 0.2 | pH��7 |
�� | 0.2 | 0.1 | pH<7 |
�����Ҫ��ش�
��1���������������c________ (ѡ��������������С��������������)0.2�����Һ������Ũ��c(A��)��c(Na��)�Ĵ�С��ϵ��______________________________________��
��2���Ӣ���ʵ����������˵��HA�ĵ���̶�________(ѡ��������������С��������������)NaA��ˮ��̶ȣ��û����Һ������Ũ���ɴ�С��˳����_____________________________��
��3������ʵ�����û����Һ����ˮ�������c(OH��)��____________mol��L��1��д���û����Һ��������ʽ�Ľ��(���������Ƽ���)��c(Na��)��c(A��)��________mol��L��1�� c(OH��)��c(HA)��________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������ԭ�������������������Ԫ��A��B��C��D��E��F�У�A��B����ͬһ������Ԫ�������ڣ�AԪ�����γɵĻ�����������࣬C��D��E��F��λ��ͬһ���ڵĽ���Ԫ�أ���̬C��Fԭ�ӵļ۵��Ӳ�δ�ɶԵ��Ӿ�Ϊ1������C��Fԭ�ӵĵ��������Ϊ10����̬D��Eԭ�ӵļ۵��Ӳ���δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������Ϊ2��
��1������Ԫ���е�һ��������С��������Ԫ�ط��ţ���ͬ�����縺�������� ��
��2����Ѫ������A��B��C��D����Ԫ���γɵ���λ������C4[D��AB��6]��������ˮ���㷺����ʳ�����Ӽ��������������д����Ѫ�εĻ�ѧʽ �� 1mol,AB���к��Цм�����ĿΪ �� ��Ѫ�ξ����и�����������������漰������ţ���
a�����Ӽ�b�����ۼ� c����λ��d�������� e�����f�����Ӽ��������
��3��E2+�ļ۲�����Ų�ͼΪ �� �ܶ�����л�����E���¿���H2�����ӳɷ�Ӧ�������ϩ������Ȳ���۱����ܼ�ȩ������̼ԭ�Ӳ�ȡsp2�ӻ��ķ���������������ţ���HCHO���ӵ�����ṹΪ�Σ����ӳɲ�����ۡ��е��CH4���ۡ��е�ߣ�����Ҫԭ��������ָ���ӳɲ����Ǻ����ʣ�
��4������C��F����ľ����ṹ��ͼ�������ж϶�Ӧ��ͼ����C��F���־��徧���н���ԭ�ӵ���λ��֮��Ϊ �� ����C�ľ����У�����þ������ܶ�Ϊag/cm3 �� �����ӵ�����ΪNA �� Cԭ�ӵ�Ħ������ΪM�����ʾCԭ�Ӱ뾶�ļ���ʽΪ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)��O2(g)![]() 2SO3(g)���Ʊ��������Ҫ��Ӧ������������ȷ����( )
2SO3(g)���Ʊ��������Ҫ��Ӧ������������ȷ����( )
A. ����V2O5���ı�÷�Ӧ���淴Ӧ����
B. ����Ӧ��ϵ��ѹǿ����Ӧ����һ������
C. �÷�Ӧ�Ƿ��ȷ�Ӧ�������¶Ƚ����̷�Ӧ�ﵽƽ���ʱ��
D. ��t1��t2ʱ�̣�SO3(g)��Ũ�ȷֱ���c1��c2����ʱ����t1��t2�ڣ�SO3(g)���ɵ�ƽ������Ϊv��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�������±��������(����)
A.����ϩ
B.�屽
C.���Ȼ�̼
D.������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com