
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
(1)六种元素中第一电离能最小的是(填元素符号,下同),电负性最大的是 .
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂).请写出黄血盐的化学式 , 1mol,AB﹣中含有π键的数目为 , 黄血盐晶体中各种微粒间的作用力不涉及(填序号).
a.离子键b.共价键 c.配位键d.金属键 e.氢键f.分子间的作用力
(3)E2+的价层电子排布图为 , 很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 . 金属C的晶胞中,若设该晶胞的密度为ag/cm3 , 阿伏加得罗常数为NA , C原子的摩尔质量为M,则表示C原子半径的计算式为 . 
【答案】
(1)K;N
(2)K4[Fe(CN)6];2NA;def
(3)![]() ;①③④;平面三角;加成产物CH3OH分子之间能形成氢键
;①③④;平面三角;加成产物CH3OH分子之间能形成氢键
(4)2:3;![]()
× ![]() cm
cm
【解析】解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2 , 3d84s2 , 故D为Fe、E为Ni,(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,所以答案是:K;N;(2)黄血盐的化学式K4[Fe(CN)6],CN﹣与氮气互为等电子体,CN﹣中存在C≡N三键,故1mol CN﹣中含有π键的数目为2NA , 黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,所以答案是:K4[Fe(CN)6];2NA;def;(3)Ni2+的价层电子排布式为3d8 , 故价电子排布图为 ![]() ;①CH2=CH2、③
;①CH2=CH2、③ 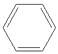 、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,所以答案是:
、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,所以答案是:![]() ;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;金属K的晶胞中,K原子数目=1+8×
;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;金属K的晶胞中,K原子数目=1+8× ![]() =2,若K原子的摩尔质量为M,阿伏加得罗常数为NA , 则晶胞质量=
=2,若K原子的摩尔质量为M,阿伏加得罗常数为NA , 则晶胞质量= ![]() g,设该晶胞的密度为a g/cm3 , 则晶胞体积=
g,设该晶胞的密度为a g/cm3 , 则晶胞体积= ![]() =
= ![]() cm3 , 晶胞棱长=
cm3 , 晶胞棱长= ![]() cm,设K原子半径为r,则晶胞体对角线长度=4r,故3(
cm,设K原子半径为r,则晶胞体对角线长度=4r,故3( ![]() cm)2=(4r)2 , 故r=
cm)2=(4r)2 , 故r= ![]() ×
× ![]() cm,所以答案是:2:3;
cm,所以答案是:2:3; ![]() ×
× ![]() cm.
cm.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )

A. HA是一种强酸
B. x点,c(A-)=c(B-)
C. HB是一种弱酸
D. 原溶液中HA的物质的量浓度为HB的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图2: 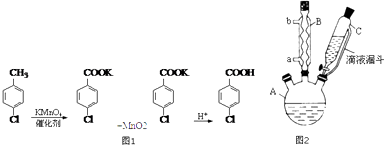
常温条件下的有关数据如表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:
(1)装置B的名称是 .
(2)量取6.00mL对氯甲苯应选用的仪器是 . (填选仪器序号).
A.10mL量筒
B.50mL容量瓶
C.50mL酸式滴定管
D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 . 对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 .
(4)第一次过滤的目的是 , 滤液中加入稀硫酸酸化,可观察到的实验现象是 .
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 .
(6)本实验的产率是(填标号).
A.60%
B.70%
C.80%
D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验室从化学试剂商店买回18.4molL﹣1的硫酸.现用该浓硫酸配制100mL 1molL﹣1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有(选填序号),还缺少的仪器有(写仪器名称).
(2)配制100mL 1molL﹣1的稀硫酸需要用量筒量取上述浓硫酸的mL(保留一位小数).
(3)实验中造成所配溶液浓度偏高的原因可能是 .
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( ) 
A.电池工作时,正极反应式:O2+2H2O+4e﹣=4OH﹣
B.去掉固体电解液和有机电解质,电池反应发生改变
C.充电时,生成14 g Li,空气极质量增加16 g
D.充电时,专用充电电极可以有效防止空气极腐蚀和劣化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1molL﹣1 NH4NO3溶液中的氮原子数为0.1NA
B.22g N2O所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.将足量铜加入54.3mL 18.4 molL﹣1浓H2SO4中充分反应产生气体的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法, ![]() 的名称是2,3﹣二乙基丁烷
的名称是2,3﹣二乙基丁烷
B.某烃的衍生物A的分子式为C6H12O2 , 已知  ,又知D不与NaHCO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有4种
,又知D不与NaHCO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有4种
C.完全燃烧相同碳原子、且相同质量的烷烃、烯烃、炔烃,耗氧量最大的是烷烃
D.已知烃A的分子式为C5Hm , 烃B的最简式为C5Hn(m、n均为正整数),则烃A和烃B不可能互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式为C6H12 , 分子结构中含有3个“﹣CH3”的烯烃共有5种
B.对苯二甲酸( ![]() )与乙二醇(HOCH2CH2OH)不能制取聚酯纤维(
)与乙二醇(HOCH2CH2OH)不能制取聚酯纤维(  )
)
C.油脂在酸或碱催化条件下可以水解.在酸性条件下的水解反应称为皂化反应,常用此反应来制取肥皂
D. 分子中的所有原子一定不可能共平面
分子中的所有原子一定不可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com