
����Ŀ��﮿�����ر�����ӵ�ؾ��и��ߵ������ܶȣ�ǰ���dz���������ṹ������ԭ����ͼ��������Һֻ����Li+ͨ�����������й�˵������ȷ���ǣ� �� 
A.��ع���ʱ��������Ӧʽ��O2+2H2O+4e��=4OH��
B.ȥ��������Һ���л�����ʣ���ط�Ӧ�����ı�
C.���ʱ������14 g Li����������������16 g
D.���ʱ��ר�ó��缫������Ч��ֹ��������ʴ���ӻ�
���𰸡�C
���������⣺A����Ϊ�õ��Ϊˮ�Ե��Һ���������������õ��ӵĻ�ԭ��Ӧ����ӦΪO2+2H2O+4e��=4OH�� �� ��A��ȷ��
B���缫��Ӧ�͵���ʻ����йأ�ȥ��������Һ���л�����ʣ���ط�Ӧ�����ı䣬��B��ȷ��
C�����ʱ������14 g Li��ת��2mol���ӣ��������������õ��ӵĻ�ԭ��Ӧ����ӦΪO2+2H2O+4e��=4OH�� �� ��������������34 g���������ӣ���C����
D�����ʱ����ϵ�صĹ����ԭ��������ר�ó��缫������Ч��ֹ��������ʴ����D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Ksp(BaSO4)=1��10��10��Ksp(BaCO3)=2.6��10��9�����¶��£�����˵������ȷ������ ��
A. ͬŨ�ȵ�Na2SO4��Na2CO3�����Һ�еμ�BaCl2��Һ��BaSO4������
B. BaCO3������Һ�м���������������ˮ��c(Ba2+)����
C. BaSO4��BaCO3���������Һ�У� 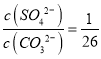
D. BaSO4����Һ�м���Na2CO3Ũ��Һ��BaSO4������ת��ΪBaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С��ͬѧ����һ����ij��ֽ���۳���Ư��Һ��NaCl��NaClO�Ļ��Һ������ʢ�ű���KAl��SO4��2��Һ�ij��У�����ж��¼�����С��ͬѧΪ̽���ж�ԭ�����������ʵ�飮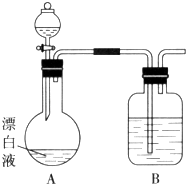
��1��С��ͬѧ����Ư��Һ����Ư�������������Ʋ⣬Ư��Һ��ClO�����������ԣ�ʵ�����£�����pH��ֽ���飬Ư��ҺpH��7������KAl��SO4��2��ҺpH��7��
��ȡ10mLƯ��Һ�����μ���Na2SO3��Һ��BaCl2��Һ���а�ɫ�������ɣ��������ɫ�������������ᣮ
����ȡ10mL��Ư��Һ������Ʒ����Һ����Һ��ɫ��dz��һ��ʱ�����Ϊ��ɫ��
������ȡ10mLƯ��Һ������Ʒ����Һ����������ϡ�����ữ����Һ��ɫ������Ϊ��ɫ��
��Ư��ҺpH����7��ԭ���ǣ������ӷ���ʽ��ʾ�� ��
����ʵ���ó�ClO�����������ԣ�д����Ӧ�����ӷ���ʽ ��
�۶Ա�ʵ���͢�˵��ClO������������Һ����ԵĹ�ϵ�� ��
��2��С��ͬѧ���ݣ�1���е�ʵ�飬�����Ư��Һ��������Һ����Cl2���ɣ�����ͼ��ʾ��װ�ü���ʵ�飬̽��Ư��Һ��������Һ���Ƿ��ܷ�Ӧ����Cl2 �� ��װ��B�������� ��
������Һ©����������ƿ�м������ᣬ������ƿ���л���ɫ���������A�з�Ӧ�����ӷ���ʽ ��
������Һ©����������ƿ�м��뱥��KAl��SO4��2��Һ�����ȹ۲쵽���������İ�ɫ��״������������ƿ���л���ɫ���������A�м�KAl��SO4��2��Һ��Ӧ�����ӷ���ʽ�� ��
��3������ʵ��˵��Ư��Һ��������Һ��ϻ����Cl2 �� ��ȡ10mLƯ��Һ������BaCl2��Һ��Ϻ���ͨ��SO2����������ʵ������п��ܵ�ʵ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�����ϸ�����л��ʵĴ�������������ѧ�ҿ�����������ȼ�ϵ�أ���װ����ͼ��a��bΪ���Ե缫�����ø�װ�ý���ˮ�е��л����C6H12O6Ϊ��������������ȥ���Ӷ��ﵽ����ˮ��Ŀ�ģ�����˵������ȷ���ǣ� �� 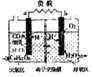
A.a�缫��ӦʽΪ��C6H12O6+6H2O��24e���T6CO2+24H+
B.��Ӧ�����в����������������ӽ���Ĥ��ɢ��������
C.�������Ҳ�缫�������غ��������缫
D.�����£��øõ�ص��һ�����ı�������ͭ��Һ���缫Ϊ���Ե缫��������ˮ�ĵ���ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���������ȡ��ˮ�������(����)
A.ֱ������
B.�ѻ�����
C.����
D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������ԭ�������������������Ԫ��A��B��C��D��E��F�У�A��B����ͬһ������Ԫ�������ڣ�AԪ�����γɵĻ�����������࣬C��D��E��F��λ��ͬһ���ڵĽ���Ԫ�أ���̬C��Fԭ�ӵļ۵��Ӳ�δ�ɶԵ��Ӿ�Ϊ1������C��Fԭ�ӵĵ��������Ϊ10����̬D��Eԭ�ӵļ۵��Ӳ���δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������Ϊ2��
��1������Ԫ���е�һ��������С��������Ԫ�ط��ţ���ͬ�����縺�������� ��
��2����Ѫ������A��B��C��D����Ԫ���γɵ���λ������C4[D��AB��6]��������ˮ���㷺����ʳ�����Ӽ��������������д����Ѫ�εĻ�ѧʽ �� 1mol,AB���к��Цм�����ĿΪ �� ��Ѫ�ξ����и�����������������漰������ţ���
a�����Ӽ�b�����ۼ� c����λ��d�������� e�����f�����Ӽ��������
��3��E2+�ļ۲�����Ų�ͼΪ �� �ܶ�����л�����E���¿���H2�����ӳɷ�Ӧ�������ϩ������Ȳ���۱����ܼ�ȩ������̼ԭ�Ӳ�ȡsp2�ӻ��ķ���������������ţ���HCHO���ӵ�����ṹΪ�Σ����ӳɲ�����ۡ��е��CH4���ۡ��е�ߣ�����Ҫԭ��������ָ���ӳɲ����Ǻ����ʣ�
��4������C��F����ľ����ṹ��ͼ�������ж϶�Ӧ��ͼ����C��F���־��徧���н���ԭ�ӵ���λ��֮��Ϊ �� ����C�ľ����У�����þ������ܶ�Ϊag/cm3 �� �����ӵ�����ΪNA �� Cԭ�ӵ�Ħ������ΪM�����ʾCԭ�Ӱ뾶�ļ���ʽΪ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������ǣ� ��
A.2molˮ��Ħ��������1molˮ��Ħ������
B.200mL1mol/L�Ȼ�����Һ��c��Cl������100mL2mol/L�Ȼ�����Һ��c��Cl����
C.64g������������ԭ�����ͱ�״����22.4Lһ����̼����ԭ����
D.20%NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10%NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������֮Դ���������ǵ�����������ء��ڻ�ѧʵ��Ϳ�ѧ�о��У�ˮҲ��һ�ֳ��õ��Լ���
��1��ˮ��������ԭ���ڻ�̬ʱ��������Ų�ʽΪ______��
��2��д����H2O���ӻ�Ϊ�ȵ��������________________����2������
��3���������ơ��⡢���ʯ���ɱ����Ȼ��ƾ���ľ���ͼ��δ��˳��������������Eͼ�ѻ���ʽ�Ŀռ�������Ϊ _________������ľ���������ͬ����________��������Ӧ�ı����д��
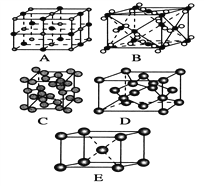
��4�������£��������أ�KO2�������������ṹ���侧���ṹ��NaCl����ͬ����ÿ�������к���___��K+��___��O2�� ��������K+ ����λ��Ϊ___ ��O2�� ����λ��Ϊ______��
��5��60 g ���ʯ�еĹ��ۼ���Ϊ_________����60g SiO2�����еĹ��ۼ���Ϊ_______����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������֬����������ȷ����( )
A. ��֬��ָ�ͺ�֬�������Dz���������
B. ��֬û�й̶����ۡ��е�
C. ��֬�Ǹ�֬����ĸ�����
D. ��֬��һ���л��ܼ������ܽ����ά����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com