
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
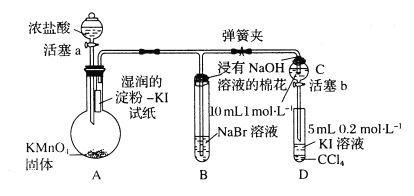
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
【答案】 2KMnO4+16HCl=5Cl2↑+2KCl+2MnCl2+8H2O 湿润的淀粉-KI试纸变蓝 C12+2Br-=Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置 CCl4层变为紫红色 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
【解析】(1)A中产生黄绿色气体氯气的化学反应方程式是2KMnO4+16HCl=5Cl2↑+2KCl+2MnCl2+8H2O。(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以验证氯气的氧化性强于碘的实验现象是淀粉KI试纸变蓝。(3)氯元素的非金属性强于溴元素的非金属性,所以氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。(4)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作和现象分别是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色。(5)由于氯气也能氧化碘化钾,干扰单质溴和碘化钾的反应,所以过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。


科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,D、E为气体单质,其中D为最轻的气体。试回答:
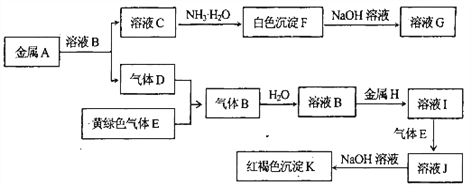
(1)写出物质K的化学式 _______________;
(2)写出A与NaOH溶液反应的化学方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:____________________________________________;
(4)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
(5)向1 L 0.2mol/L的C溶液中加入a ml 5mol/L的NaOH溶液得到了7.8g沉淀,求a=____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l
D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
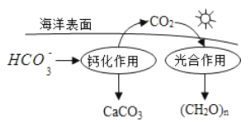
【题目】研究 CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的 CO2 主要以 4 种无机碳形式存在,其中 HCO3-占 95%,写出 CO2溶于水产生 HCO3-的方程式: ___________、___________。
(2)在海洋循环中,通过如图所示的途径固碳, 写出钙化作用的离子方程式__________。
(3)海水中溶解无机碳占海水总碳的 95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:①气提、吸收 CO2 。用 N2 从 H2SO4溶液酸化后的 Z mL海水中吹出 CO2 并用碱液吸收(装置如图)
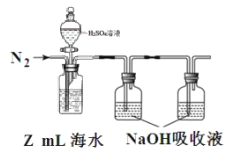
②滴定。将吸收液吸收的无机碳转化为 NaHCO3,再用x mol/L盐酸滴定,消耗y mL盐酸,则海水中溶解无机碳的浓度=________mol/L。
(4)利用下图所示装置从海水中提取 CO2,有利于减少环境温室气体含量。
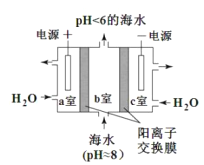
①提取CO2 的原理:_____(填 a 或 b)室产生的 H+ 通过阳离子膜进入b 室,发生反应:。 ________。
②用该装置产生的物质处理 b 室排出的海水,合格后排回大海。处理至合格的具体方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的pH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+2OH--2e-=== ClO-+H2O
C. 阴极附近碱性增强,阳极附近碱性减弱
D. 除去CN-的反应:5ClO-+2CN-+2H+ === N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
A.容量瓶事先未烘干
B.定容时俯视观察液面
C.未用蒸馏水洗涤烧杯
D.定容后,摇匀时有少量液体流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式错误的是
A. NaHCO3═Na++H++CO32- B. NaHSO4═Na++H++SO42-
C. MgCl2═Mg2++2Cl- D. Ba(OH)2═Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoO是电子陶瓷所需的重要原料,工业上可用含有Co2O3、Fe2O3、Li和Al等物质的废料制备CoO。生产流程如下:
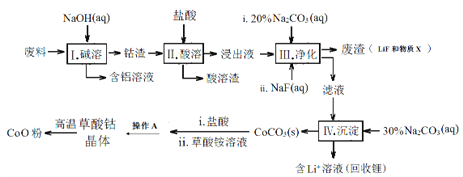
已知:① Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2 + ↑+ 3H2O,_______此反应的目的是_____________。
(2)步骤Ⅲ中加入Na2CO3溶液的作用是___________,物质X的化学式为___________。
(3)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是___________。
(4)将所得的草酸钴14.7g高温灼烧,其热重分析图如右图:
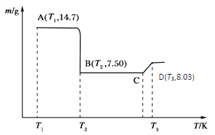
写出B点物质的化学式:___________,CD段发生反应的化学方程式为:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com