
【题目】下列物质在水溶液中的电离方程式错误的是
A. NaHCO3═Na++H++CO32- B. NaHSO4═Na++H++SO42-
C. MgCl2═Mg2++2Cl- D. Ba(OH)2═Ba2++2OH-
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】下列表述方式错误的是( )
A.Fe的基态原子外围电子排布图: ![]()
B.氯化钠的分子式:NaCl
C.N的基态原子核外电子排布式:1S22S22p3
D.HC1O的结构式:H﹣O﹣Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
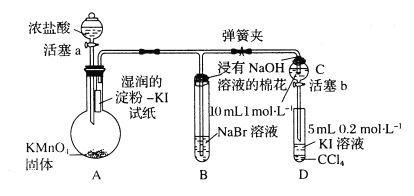
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙烯有下列叙述: ①乙烯能发生加聚反应
②乙烯溶于水后可得乙醇
③乙烯能与溴水发生加成反应
④可以用高锰酸钾溶液来鉴别乙烯和甲烷
⑤乙烯是无色易溶于水的气体
其中正确的是( )
A.②⑤
B.①③④
C.①②③
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1 . B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是 , B是 , C是 , D是 , E是 .
(2)B、C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示) .
(3)元素B与D的电负性的大小关系是 , C与E的第一电离能的大小关系是 . (填>、<、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子排布 .
(5)写出A和B按原子个数比1:1形成的化合物的电子式 .
(6)用电子式表示D和E形成离子化合物的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. Fe3O4 溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. 硫化钠的水解反应:S2-+H3O+![]() HS-+H2O
HS-+H2O
C. 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓
D. NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
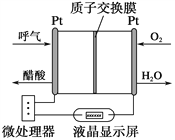
A. 该电池的负极反应式为CH3CH2OH+3H2O12e===2CO2↑+12H+
B. 该电池的正极反应式为O2+4e+4H+===2H2O
C. 电流由O2所在的铂电极经外电路流向另一电极
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,充入一定量的NO和O2,800 ℃时发生反应2NO(g)+O2(g) ![]() 2NO2(g),n(NO)随时间的变化如表:
2NO2(g),n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应在1 s~2 s内,O2的物质的量减少________mol。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0~2s内该反应的平均速率v=________。
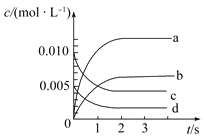
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com