
【题目】能正确表示下列反应的离子方程式是( )
A. Fe3O4 溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. 硫化钠的水解反应:S2-+H3O+![]() HS-+H2O
HS-+H2O
C. 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓
D. NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l
D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式错误的是
A. NaHCO3═Na++H++CO32- B. NaHSO4═Na++H++SO42-
C. MgCl2═Mg2++2Cl- D. Ba(OH)2═Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种重要的金属,锌及其化合物有着广泛的应用.
(1)指出锌在周期表中的位置:第周期第族,属于区.
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式;葡萄糖分子[CH2OHCHOH(CHOH)3CHO]中碳原子杂化方式有 .
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+ . 配位体NH3分子中心原子的 杂化方式是 , 属于(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中用箭头表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键 . 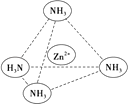
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.临氯甲苯、1,2﹣二氯乙烷、3﹣甲基﹣1﹣丁烯的结构简式分别为: 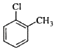 CH2Cl﹣CH2Cl
CH2Cl﹣CH2Cl ![]()
B.2,3,4一三甲基戊烷的核磁共振氢谱中出现五组峰
C.3,4一二甲基己烷的一氯代产物有4种
D.甲苯、硝基苯、2﹣甲基丙烯分子中的所有碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoO是电子陶瓷所需的重要原料,工业上可用含有Co2O3、Fe2O3、Li和Al等物质的废料制备CoO。生产流程如下:
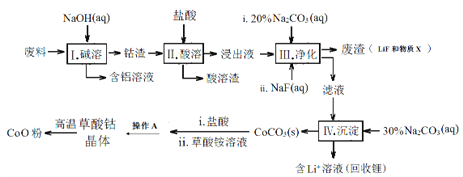
已知:① Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2 + ↑+ 3H2O,_______此反应的目的是_____________。
(2)步骤Ⅲ中加入Na2CO3溶液的作用是___________,物质X的化学式为___________。
(3)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是___________。
(4)将所得的草酸钴14.7g高温灼烧,其热重分析图如右图:
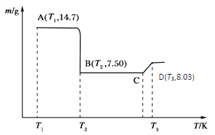
写出B点物质的化学式:___________,CD段发生反应的化学方程式为:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用激光笔照射硫酸铜溶液,侧面可观察到明显的光路
B.氢氧化铁胶体带正电荷是氢氧化铁胶体稳定存在的主要原因
C.根据是否有丁达尔效应,将分散系分为溶液、胶体、浊液
D.江河入海口三角洲的形成通常与胶体的性质有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com