
ЁОЬтФПЁПCoOЪЧЕчзгЬеДЩЫљашЕФживЊдСЯЃЌЙЄвЕЩЯПЩгУКЌгаCo2O3ЁЂFe2O3ЁЂLiКЭAlЕШЮяжЪЕФЗЯСЯжЦБИCoOЁЃЩњВњСїГЬШчЯТЃК
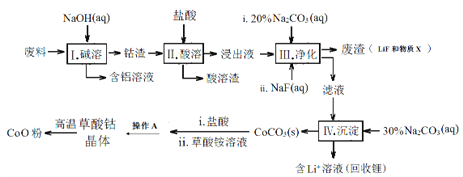
вбжЊЃКЂй Li2CO3ЮЂШмгкЫЎЃЛ
ЂкВПЗжН№ЪєРызгаЮГЩЧтбѕЛЏЮяГСЕэЕФpHМћЯТБэЃК
Fe3+ | Co2+ | Co3+ | Al3+ | |
pHЃЈПЊЪМГСЕэЃЉ | 1.9 | 7.15 | -0.23 | 3.4 |
pHЃЈЭъШЋГСЕэЃЉ | 3.2 | 9.15 | 1.09 | 4.7 |
ЃЈ1ЃЉВНжшЂђжаЫсШмЪБЗЂЩњСЫЗДгІЃКCo2O3+6H++2Cl-=2 + Ёќ+ 3H2OЃЌ_______ДЫЗДгІЕФФПЕФЪЧ_____________ЁЃ
ЃЈ2ЃЉВНжшЂѓжаМгШыNa2CO3ШмвКЕФзїгУЪЧ___________ЃЌЮяжЪXЕФЛЏбЇЪНЮЊ___________ЁЃ
ЃЈ3ЃЉВНжшЂѓжаМгШыNaFЖдВНжшЂєЫљЦ№ЕФзїгУЪЧ___________ЁЃ
ЃЈ4ЃЉНЋЫљЕУЕФВнЫсюм14.7gИпЮТзЦЩеЃЌЦфШШжиЗжЮіЭМШчгвЭМЃК
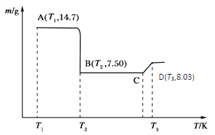
аДГіBЕуЮяжЪЕФЛЏбЇЪНЃК___________ЃЌCDЖЮЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК_________________________ЁЃ
ЁОД№АИЁП Co2+ЁЂCl2 ШмНтCo2O3,НЋШ§МлюмзЊЛЏЮЊЖўМлЃЌБугкГСЕэГ§ШЅШ§МлЬњ ЕїНкШмвКЕФpH Fe(OH)3 НЕЕЭШмвКжаЕФLi+ХЈЖШЃЌБмУтВНжшIV жаВњЩњЬМЫсяЎГСЕэ CoO 6CoO+O2=2Co3O4
ЁОНтЮіЁПЃЈ1ЃЉ.КЌюмЗЯСЯжаКЌгаCo2O3ЁЂFe2O3КЭЩйСПLiЁЂAlЃЌЯђЗЯСЯжаМгШыNaOHШмвКЃЌжЛгаAlКЭNaOHЗДгІЩњГЩПЩШмадЕФNaAlO2ЃЌLiКЭЫЎЗДгІЩњГЩЮЂШмЕФLiOHЃЌШЛКѓЙ§ТЫЕУЕНТЫдќCo2O3ЁЂFe2O3КЭЩйСПLiOHЃЌТЫвКжаКЌгаNaOHКЭNaAlO2ЃЌЯђТЫдќжаМгШыХЈбЮЫсЫсШмЃЌЗЂЩњЗДгІCo2O3+6HCl=2CoCl2+Cl2Ёќ+3H2OЃЌРызгЗНГЬЪНЮЊЃКCo2O3+6H++2Cl-=2Co2++Cl2Ёќ+3H2OЃЛгЩБэжаЪ§ОнКЭЩЯЪіЗДгІЗНГЬЪНПЩжЊЃЌЗЂЩњДЫЗДгІЕФФПЕФЪЧШмНтCo2O3ЃЌНЋШ§МлюмзЊЛЏЮЊCo2+ЃЌБугкГСЕэГ§ШЅFe3+ЃЌЙЪД№АИЮЊЃКCo2+ЁЂCl2ЃЛШмНтCo2O3ЃЌНЋШ§МлюмзЊЛЏЮЊЖўМлЃЌБугкГСЕэГ§ШЅШ§МлЬњЃЛ
ЃЈ2ЃЉ.ВНжшЂѓжаМгШыNa2CO3ШмвКЕФзїгУЪЧЕїНкШмвКЕФpHЃЌЪЙШмвКРяЕФFe3+ЭъШЋзЊЛЏЮЊFe(OH)3ЃЌЙЪД№АИЮЊЃКЕїНкШмвКЕФpHЃЛFe(OH)3ЃЛ
ЃЈ3ЃЉ.ВНжшЂѓжаМгШыNaFПЩвдНЕЕЭШмвКжаLi+ХЈЖШЃЌБмУтВНжшЂєжаВњЩњLi2CO3ГСЕэЃЌЙЪД№АИЮЊЃКНЕЕЭШмвКжаЕФLi+ХЈЖШЃЌБмУтВНжшЂєжаВњЩњЬМЫсяЎГСЕэЃЛ
ЃЈ4ЃЉ. AЮЊCoC2O4ЃЌn(CoC2O4)=14.7gЁТ147g/mol=0.1molЃЌm(Co)=0.1molЁС59g/mol=5.9gЃЌдђBЕуЪБЃЌЙЬЬхжабѕдзгЕФЮяжЪЕФСПЮЊn(O)=(7.5g5.9g)ЁТ16g/mol=0.1molЃЌдђюмдзггыбѕдзгЕФЮяжЪЕФСПжЎБШЮЊ0.1mol:0.1mol=1:1ЃЌМДBЕуЙЬЬхЮяжЪЕФЛЏбЇЪНЮЊCoOЃЛCЕубѕЛЏЮяЕФжЪСПЮЊ8.03gЃЌдђn(O)=ЃЈ14.7g8.03gЃЉЁТ16g/mol=0.133molЃЌюмдзггыбѕдзгЕФЮяжЪЕФСПжЎБШЮЊ0.1mol:0.133mol=3:4ЃЌПЩжЊCЕуЙЬЬхЕФЛЏбЇЪНЮЊCo3O4ЃЌдђCDЖЮЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ6CoO+O2=2Co3O4ЃЌЙЪД№АИЮЊЃКCoO ЃЛ6CoO+O2=2Co3O4ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊбщжЄТБЫиЕЅжЪбѕЛЏадЕФЯрЖдЧПШѕЃЌФГаЁзщгУЯТЭМЫљЪОзАжУНјааЪЕбщЃЈМаГжвЧЦїМКТдШЅЃЌЦјУмадвбМьбщЃЉЁЃ
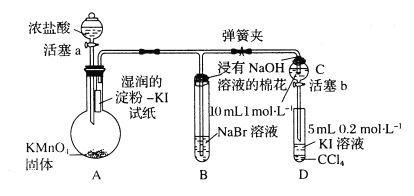
ЪЕбщЙ§ГЬЃК
IЃЎДђПЊЕЏЛЩМаЃЌДђПЊЛюШћaЃЌЕЮМгХЈбЮЫсЁЃ
IIЃЎЕБBКЭCжаЕФШмвКЖМБфЮЊЛЦЩЋЪБЃЌМаНєЕЏЛЩМаЁЃ
III.ЕБBжаШмвКгЩЛЦЩЋБфЮЊКьзиЩЋЪБЃЌЙиБеЛюШћaЁЃ
IVЃЎЁЁ
(1)AжаВњЩњЛЦТЬЩЋЦјЬхЕФЛЏбЇЗДгІЗНГЬЪНЪЧ___________ЁЃ
(2)бщжЄТШЦјЕФбѕЛЏадЧПгкЕтЕФЪЕбщЯжЯѓЪЧ___________ЁЃ
(3)BжаШмвКЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧ___________ЁЃ
(4)ЮЊбщжЄфхЕФбѕЛЏадЧПгкЕтЃЌЙ§ГЬЂєЕФВйзїЪЧ___________ЃЌЯжЯѓЪЧ___________ЁЃ
(5)Й§ГЬIIIЪЕбщЕФФПЕФЪЧ___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФме§ШЗБэЪОЯТСаЗДгІЕФРызгЗНГЬЪНЪЧЃЈ ЃЉ
A. Fe3O4 ШмгкзуСПЯЁHNO3ЃКFe3O4+8H+=Fe2++2Fe3++4H2O
B. СђЛЏФЦЕФЫЎНтЗДгІЃКS2-+H3O+![]() HS-+H2O
HS-+H2O
C. НЋ0.2mol/LЕФNH4Al(SO4)2ШмвКгы0.3mol/LЕФBa(OH)2ШмвКЕШЬхЛ§ЛьКЯЃК2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3Ё§+3BaSO4Ё§
D. NH4HCO3ШмвКгызуСПBa(OH)2ШмвКЛьКЯЃКHCO3-+Ba2++OH-=BaCO3Ё§+H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЫљЪОЪЧвЛжжЫсадШМСЯЕчГиОЦОЋМьВтвЧЃЌОпгаздЖЏДЕЦјСїСПеьВтгыПижЦЕФЙІФмЃЌЗЧГЃЪЪКЯНјааЯжГЁОЦОЋМьВтЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
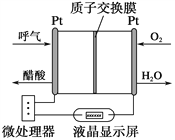
A. ИУЕчГиЕФИКМЋЗДгІЪНЮЊCH3CH2OH+3H2O12e===2CO2Ёќ+12H+
B. ИУЕчГиЕФе§МЋЗДгІЪНЮЊO2+4e+4H+===2H2O
C. ЕчСїгЩO2ЫљдкЕФВЌЕчМЋОЭтЕчТЗСїЯђСэвЛЕчМЋ
D. ЮЂДІРэЦїЭЈЙ§МьВтЕчСїДѓаЁЖјМЦЫуГіБЛВтЦјЬхжаОЦОЋЕФКЌСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАЮяжЪЕФСПЁБЪЧжИ(ЁЁЁЁ)
A.ЮяжЪЕФжЪСП
B.ЮяжЪЕФЮЂЙлСЃзгЪ§
C.ЮяжЪЕФжЪСПгыЮЂЙлСЃзгЪ§
D.АбЮяжЪЕФжЪСПЭЌЮЂЙлСЃзгЪ§СЊЯЕЦ№РДЕФвЛИіЛљБОЮяРэСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЫсЪЧвЛжжживЊЕФЛЏЙЄВњЦЗЃЌСђЫсЕФЯћКФСПГЃБЛЪгЮЊвЛИіЙњМвЙЄвЕЗЂеЙЫЎЦНЕФвЛжжБъжОЁЃФПЧАСђЫсЕФживЊЩњВњЗНЗЈЪЧЁАНгДЅЗЈЁБЃЌгаЙиНгДЅбѕЛЏЗДгІ2SO2+O2![]() 2SO3ЕФЫЕЗЈВЛе§ШЗЕФЪЧ
2SO3ЕФЫЕЗЈВЛе§ШЗЕФЪЧ
A. ИУЗДгІЮЊПЩФцЗДгІЃЌЙЪдквЛЖЈЬѕМўЯТЖўбѕЛЏСђКЭбѕЦјВЛПЩФмШЋВПзЊЛЏЮЊШ§бѕЛЏСђ
B. ДяЕНЦНКтКѓЃЌЗДгІОЭЭЃжЙСЫЃЌЙЪДЫЪБе§ЁЂФцЗДгІЫйТЪЯрЕШЧвОљЮЊ0
C. вЛЖЈЬѕМўЯТЃЌЯђФГУмБеШнЦїжаМгШы2 mol SO2КЭ1 mol O2ЃЌдђДгЗДгІПЊЪМЕНДяЦНКтЕФЙ§ГЬжаЃЌе§ЗДгІЫйТЪВЛЖЯМѕаЁЃЌФцЗДгІЫйТЪВЛЖЯдіДѓЃЌФГвЛЪБПЬЃЌе§ЁЂФцЗДгІЫйТЪЯрЕШ
D. дкРћгУЩЯЪіЗДгІЩњВњШ§бѕЛЏСђЪБЃЌвЊЭЌЪБПМТЧЗДгІЫљФмДяЕНЕФЯоЖШКЭЛЏбЇЗДгІЫйТЪСНЗНУцЕФЮЪЬт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A.ЭЈЙ§ЪЏгЭЕФСбНтПЩвдЛёЕУИќЖрЕФЦћгЭ
B.ЕААзжЪЁЂЯЫЮЌЫиЁЂгЭжЌЁЂОлввЯЉЁЂЕэЗлЖМЪЧИпЗжзгЛЏКЯЮя
C.бажЦввДМЦћгЭЃЈЦћгЭжаЬэМгвЛЖЈБШР§ЕФввДМЃЉММЪѕЃЌПЩвдНЕЕЭЛњЖЏГЕСОЮВЦјжагаКІЦјЬхХХЗХ
D.ЪЏгЭЁЂУКЁЂЬьШЛЦјЁЂжВЮягЭЖМЪєгкЛЏЪЏШМСЯ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк2 LУмБеШнЦїФкЃЌГфШывЛЖЈСПЕФNOКЭO2ЃЌ800 ЁцЪБЗЂЩњЗДгІ2NO(g)+O2(g) ![]() 2NO2(g)ЃЌn(NO)ЫцЪБМфЕФБфЛЏШчБэЃК
2NO2(g)ЃЌn(NO)ЫцЪБМфЕФБфЛЏШчБэЃК
ЪБМф/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)ЗДгІдк1 sЁЋ2 sФкЃЌO2ЕФЮяжЪЕФСПМѕЩй________molЁЃ
(2)ШчЭМЫљЪОЃЌБэЪОNO2БфЛЏЧњЯпЕФЪЧ________ЁЃгУO2БэЪОДг0ЁЋ2sФкИУЗДгІЕФЦНОљЫйТЪv=________ЁЃ
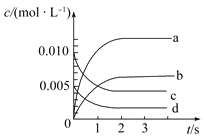
(3)ФмЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ________(ЬюађКХ)ЁЃ
aЃЎv(NO2)=2v(O2) bЃЎШнЦїФкбЙЧПБЃГжВЛБф
cЃЎvФц(NO)=2vе§(O2) dЃЎШнЦїФкУмЖШБЃГжВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщРызгжаЕФРызгЃЌФмдкШмвКжаДѓСПЙВДцЕФЪЧЃЈ ЃЉ
A.NaЃЋЁЂMg2+ЁЂClЃЁЂOHЃB.HЃЋЁЂCa2+ЁЂCO32-ЁЂNO3-
C.Cu2+ЁЂKЃЋЁЂSO42-ЁЂNO3-D.NaЃЋЁЂHЃЋЁЂOHЃЁЂCa2+
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com