
【题目】配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
A.容量瓶事先未烘干
B.定容时俯视观察液面
C.未用蒸馏水洗涤烧杯
D.定容后,摇匀时有少量液体流出
【答案】C
【解析】解:A、容量瓶事先未烘干,由于定容还需要加入蒸馏水,所以不影响溶质的物质的量和溶液的体积,即不影响配制结果,故A错误;B、定容时俯视观察液面,导致加入的蒸馏水体积偏小,根据c= ![]() 可得,配制的溶液浓度偏高,故B错误;
可得,配制的溶液浓度偏高,故B错误;
C、未用蒸馏水洗涤烧杯,导致配制溶液中溶质的物质的量偏小,根据c= ![]() 可得,配制的溶液浓度偏低,故C正确;
可得,配制的溶液浓度偏低,故C正确;
D、定容后,摇匀时有少量液体流出,由于溶液的均一性,所以不影响配制结果,故D错误;
故选C.
【考点精析】解答此题的关键在于理解配制一定物质的量浓度的溶液的相关知识,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的价电子排布式为_______,其排布时能量最高的电子所占据能级的原子轨道有_______个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______。与CN-互为等电子体的一种分子的化学式为________ 。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF5、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为_______。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为_______。
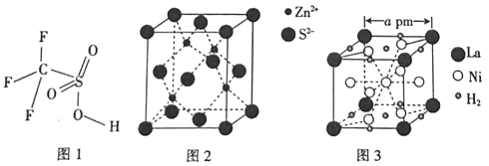
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为_________。
(6)镧镍合金是重要的储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为_________。
②该镧镍合金储氢后氢的密度为_________(用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知: ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) Δ H=+93.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)=CO2(g)+2H2(g) Δ H=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) Δ H=-38.19 kJ·mol-1
则表示 CH3OH 的燃烧热的热化学方程式为___________ 。
(2)在一定条件下用CO和H2合成 CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。
CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。

回答下列问题:
①该反应的反应热 Δ H________ 0(填“>” 或“<” ),压强的相对大小与p1_______ p2(填“>” 或“<” )。
②压强为 p2,温度为 300℃时,该反应的化学平衡常数的计算式为K=_______(只列算式不计算结果)。
③下列各项中,不能说明该反应已经达到平衡的是_______。
A.容器内气体压强不再变化
B.υ (CO):υ (H2)=1:2
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, 平衡_______。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
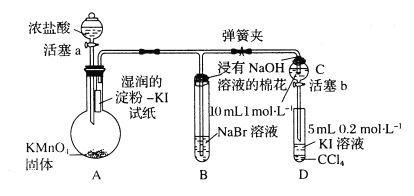
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1 . B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是 , B是 , C是 , D是 , E是 .
(2)B、C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示) .
(3)元素B与D的电负性的大小关系是 , C与E的第一电离能的大小关系是 . (填>、<、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子排布 .
(5)写出A和B按原子个数比1:1形成的化合物的电子式 .
(6)用电子式表示D和E形成离子化合物的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志。目前硫酸的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2![]() 2SO3的说法不正确的是
2SO3的说法不正确的是
A. 该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B. 达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为0
C. 一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D. 在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com