
【题目】下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。下列说法正确的是

A. 化合物甲中的含氧官能团有羰基和酯基
B. 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙
C. 化合物乙不能发生消去反应
D. 化合物丙能和FeCl3溶液发生显色反应
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】(1)根据氧化还原反应2H2+O2===2H2O,设计成燃料电池,负极通的气体应是___________。
(2)如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是_____。

A.a电极是负极
B.b电极的电极反应为4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(3)根据氢氧燃料电池电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应 | ______________ | |
正极反应 | ___________ | |
溶液的pH变化 | _____________ |
(4)若把H2改为CH4,KOH溶液作电解质溶液,则负极反应为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中能与醋酸发生反应的是
①石蕊 ②乙醇 ③溴乙烷 ④金属铝 ⑤氧化镁 ⑥碳酸钙 ⑦氢氧化铜 ⑧苯
A.①④⑤⑥⑦⑧ B.②③④⑤⑧ C.①②④⑤⑥⑦ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
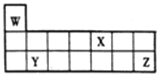
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上烟气脱氮的原理 NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数 K 的表达式为_____________________。如果平衡常数 K 值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变
b.容器内气体的压强不变
c.反应消耗 0.5mol NO 的同时生成 1mol N2 d.NO2 的浓度不变
(3)向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测得平衡时气体的物质的量增加了 0.2mol,则用H2O(g)表示的平均反应速率为__________________。
(4)如图是 P1 压强下 NO 的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2> P1)下 NO 的转化率随反应时间变化的示意图________________。

(5)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥 NH4Cl。NH4Cl 溶液显_____________性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中 NH3·H2O、H+、OH-、NH4+、Cl 一浓度由大到小的关系是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
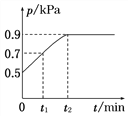
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com