
【题目】下列物质中能与醋酸发生反应的是
①石蕊 ②乙醇 ③溴乙烷 ④金属铝 ⑤氧化镁 ⑥碳酸钙 ⑦氢氧化铜 ⑧苯
A.①④⑤⑥⑦⑧ B.②③④⑤⑧ C.①②④⑤⑥⑦ D.全部
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体分子且键角都为109°28′
C. NaCl晶体中与每个Na+距离相等且最近的Na+共有8个
D. 单质的晶体中一定不存在的微粒是阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。

(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
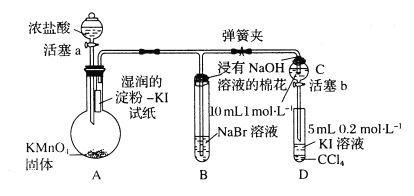
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工厂采用含硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3 mol/L,氢氟酸的浓度为8 mol/L。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol/L,硫酸的浓度为1 mol/L。现要用此回收酸液配制上述萃取液,在400 L回收酸液中加入________________L(小数点后保留一位有效数字)密度为1.84 g/cm3、浓度为98%的浓硫酸,然后 ________,即可得到符合要求的萃取液。
II.某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
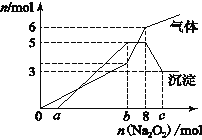
(1)该溶液中一定含有的阳离子是____________________,其对应物质的量浓度之比为___________________________,溶液中一定不存在的阴离子是_________________________。
(2)写出沉淀减少的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。下列说法正确的是

A. 化合物甲中的含氧官能团有羰基和酯基
B. 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙
C. 化合物乙不能发生消去反应
D. 化合物丙能和FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体试样A是由一定量的Al、Mg均匀组成的混合物,为验证混合物的组成,进行如下实验:
①取m g试样A,全部溶于0.5L 2mol·L-1稀硫酸溶液中,放出11.2 L气体(已换算成标准状况),同时生成溶液B;
②另取m g试样A,加入2mol·L-1的NaOH溶液,当加到100mL时,气体不再生成;
③往溶液B中加入2mol/L NaOH,至沉淀不再发生变化。
根据以上过程回答下列问题:
(1)溶液B中是否含有H+_____________(填“是”或“否”);
(2)写出②中发生反应的离子方程式____________________________________;
(3)下列能表示过程③产生的沉淀质量W与加入NaOH溶液体积V的关系是_____;
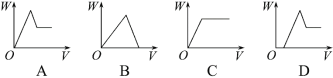
(4)m g试样A中含Mg的质量为________g;
(5)林同学通过查阅资料,发现浓硫酸与铝发生钝化,但与Mg能剧烈反应生成SO2,如果忽略钝化的反应过程,可以通过测定浓硫酸与固体试样反应产生的气体体积,来确定混合物A中镁的质量分数。
郭同学认为林同学的方案可行,但考虑到如果反应结束后硫酸未保持“浓”的状态,测定结果会____________(填“偏大”、“偏小”或“不变”),其依据是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L氯化铁和氯化铝的混合液中,Fe3+的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为1.8 mol/L。要使Fe3+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为( )
A. 450mL B. 500mL C. 300mL D. 200mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com