
����Ŀ��ij��������A����һ������Al��Mg������ɵĻ���Ϊ��֤��������ɣ���������ʵ�飺
��ȡm g����A��ȫ������0.5L 2mol��L����ϡ������Һ�У��ų�11.2 L����(�ѻ���ɱ�״��)��ͬʱ������ҺB��
����ȡm g����A������2mol��L������NaOH��Һ�����ӵ�100mLʱ�����岻�����ɣ�
������ҺB�м���2mol/L NaOH�����������ٷ����仯��
�������Ϲ��̻ش��������⣺
(1)��ҺB���Ƿ���H+_____________(��ǡ���)��
(2)д�����з�����Ӧ�����ӷ���ʽ____________________________________��
(3)�����ܱ�ʾ���̢۲����ij�������W�����NaOH��Һ���V�Ĺ�ϵ��_____��
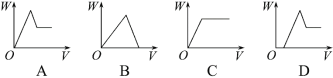
(4)m g����A�к�Mg������Ϊ________g��
(5)��ͬѧͨ���������ϣ�����Ũ�������������ۻ�������Mg�ܾ��ҷ�Ӧ����SO2��������Զۻ��ķ�Ӧ���̣�����ͨ���ⶨŨ���������������Ӧ�����������������ȷ�������A��þ������������
��ͬѧ��Ϊ��ͬѧ�ķ������У������ǵ������Ӧ����������δ���֡�Ũ����״̬���ⶨ�����____________(�ƫ����ƫС�����䡱)����������_______________________________________________________��
���𰸡��� 2Al+2OH-+2H2O=2AlO2-+3H2�� D 4.8 ƫ�� Ũ�����ϡ���������Ӧ��ʹ���ɵ�����ƫ�࣬þ�����������ⶨ���ƫ��
��������
þ����������ϡ���ᷴӦ������������ֻ��������������Һ��Ӧ�������������������������������������þ������ǿ�����й����ʵ����ʵ����ͷ�Ӧ�ķ���ʽ�������
��1��0.5L 2mol��L����ϡ������Һ����������ʵ�����0.5L��2mol/L��1.0mol�����շų����������ʵ�����11.2L��22.4L/mol��0.5mol��������ԭ���غ��֪���������������ҺB�к���H+��
��2����ȡm g����A������2mol��L������NaOH��Һ�����ӵ�100mLʱ�����岻�����ɣ��ù�����ֻ����������������Һ��Ӧ������з�����Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2����
��3��������Һ��B�к������ᡢ����þ�����������������ҺB�м���2mol/L NaOH�����������ٷ����仯ʱ���ȷ����кͷ�Ӧ��Ȼ������������þ���Ӻ������ӣ�������������ܽ��������������ܱ�ʾ���̢۲����ij�������W�����NaOH��Һ���V�Ĺ�ϵ��ͼ��D����ѡD��
��4��������Ӧ���������Ƶ����ʵ�����2mol/L��0.1L��0.2mol�����ݷ���ʽ��֪2Al+2OH-+2H2O=2AlO2-+3H2������������0.3mol��������ͬ����������ϡ���ᷴӦҲ����0.3mol��������þ���ɵ�������0.5mol��0.3mol��0.2mol�����Ը��ݷ���ʽMg+2H+��Mg2++H2����֪þ��������0.2mol��24g/mol��4.8g��
��5������Ũ�����ϡ���������Ӧ��ʹ���ɵ�����ƫ�࣬�Ӷ�����þ�����������ⶨ���ƫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
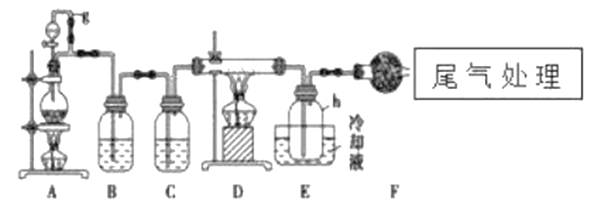
����Ŀ������������Ϣ��ҵ����Ҫ�Ļ������ϡ�ͨ����̼�ڸ����»�ԭ���������Ƶôֹ裨�����������������ʣ����ֹ���������Ӧ�������Ȼ��裨��Ӧ�¶�450-500�棩�����Ȼ��辭�ᴿ����������ԭ�ɵøߴ��衣������ʵ�����Ʊ����Ȼ����װ��ʾ��ͼ��
�����Ϣ���£�
a.���Ȼ���Ӵ�ˮ�ᷢ����ѧ��Ӧ��
b.�������������ڸ����¾���������ֱ�ӷ�Ӧ������Ӧ���Ȼ��
c.�й����ʵ������������±���
���� | SiCl4 | BC13 | A1C13 | FeCl3 | PCl5 |
�е�/�� | 57.7 | 12.8 | �� | 315 | �� |
�۵�/�� | -70.0 | -107.2 | �� | �� | �� |
�����¶�/�� | �� | �� | 180 | 300 | 162 |
��ش��������⣺
��1��д��װ��A�з�����Ӧ�����ӷ���ʽ��___________��D�з�����Ӧ�Ļ�ѧ����ʽ___________��
��2��A��g�ܵ�������__________________��װ��C�е��Լ���___________��������___________��
��3��װ��E�е�hƿ��Ҫ��ȴ��������______________________��
��4��װ��E��hƿ�ռ����Ĵֲ����ͨ���������ƶ�����õ��ߴ������Ȼ��裬�����IJ������У�����Ԫ������ܻ����е�����Ԫ����___________����дԪ�ط��ţ���
��5������������������ʯ��������������д���÷�Ӧ�Ļ�ѧ����ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ᷢ����Ӧ����
��ʯ�� ���Ҵ� �������� �������� ������þ ��̼��� ��������ͭ ����
A���٢ܢݢޢߢ� B���ڢۢܢݢ� C���٢ڢܢݢޢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�Ӻ���3p�Dz��еĵ��ӣ�����ͬ����
A. ��������չ����B. ��������״
C. ����D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������д��ڵ���ƽ�⣺H2S![]() H++HS-��HS-
H++HS-��HS-![]() H++S2-����֪��ʽ��NaHS��Һ�ʼ��ԣ�����10mlŨ��Ϊ0.1mol/L���������м����������ʣ������ж���ȷ����
H++S2-����֪��ʽ��NaHS��Һ�ʼ��ԣ�����10mlŨ��Ϊ0.1mol/L���������м����������ʣ������ж���ȷ����
A. ��ˮ����ʹƽ�������ƶ�����Һ��������Ũ������
B. ����20mlŨ��Ϊ0.1mol/L NaOH��Һ����c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. ͨ�����SO2���壬ƽ�������ƶ�����ҺpHֵʼ������
D. ����10mlŨ��Ϊ0.1mol/L NaOH��Һ����c(Na+)>c(HS-)>c(OH��)>c(H+)>c(S2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ���������������Ԫ�صĴ��ڵIJ�����
A. ����������ֱ�Ӽ���AgNO3��Һ
B. ���������м�����ˮ��Ȼ�����AgNO3��Һ
C. ���������м����Ҵ������ȣ�Ȼ�����AgNO3��Һ
D. ���������м���NaOH��Һ�����Ⱥ��ữ��Ȼ�����AgNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������ѵ���ԭ�� NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)+Q(Q>0)
��1���÷�Ӧ��ѧƽ�ⳣ�� K �ı���ʽΪ_____________________�����ƽ�ⳣ�� K ֵ����_______(�����Ӧ�����淴Ӧ��)������Ӱ�����
��2������Ӧ�ں��������½��У���˵����Ӧ�Ѿ��ﵽƽ��״̬����______(�����)
a�������ڻ�������������
b�������������ѹǿ����
c����Ӧ���� 0.5mol NO ��ͬʱ���� 1mol N2 d��NO2 ��Ũ�Ȳ���
��3���� 2 L �ܱ������м��뷴Ӧ�10 min ��ﵽƽ�⣬���ƽ��ʱ��������ʵ��������� 0.2mol������H2O(g)��ʾ��ƽ����Ӧ����Ϊ__________________��
��4����ͼ�� P1 ѹǿ�� NO ��ת�����淴Ӧʱ��(t)�ı仯ͼ������ͼ�л�������������������£�ѹǿΪP2(P2> P1)�� NO ��ת�����淴Ӧʱ��仯��ʾ��ͼ________________��

��5��д����Ӧ���еİ����ĵ���ʽ______����ռ乹��Ϊ______������������������ NH4Cl��NH4Cl ��Һ��_____________�ԣ������½��������Ũ�ȵİ�ˮ��NH4Cl��Һ��ϣ�pH>7����Һ�� NH3��H2O��H+��OH����NH4+��Cl һŨ���ɴ�С�Ĺ�ϵ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ӷ�Ӧ����
A.H2��O2��Ӧ����ˮB.пƬͶ��ϡ������
C.˫��ˮ(H2O2)�ֽ���ȡO2D.��¯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ����������ίԱ����ȷ����116��Ԫ��Lv������Ϊ�W������![]() �������������
�������������
A. ԭ������116 B. ������177
C. ���������116 D. ���ԭ������293
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com