
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
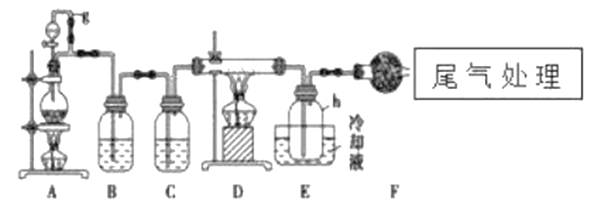
相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BC13 | A1C13 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:___________,D中发生反应的化学方程式___________。
(2)A中g管的作用是__________________,装置C中的试剂是___________,作用是___________。
(3)装置E中的h瓶需要冷却的理由是______________________。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是___________(填写元素符号)。
(5)过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式_____________________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2Cl2+Si
MnCl2+Cl2↑+2H2O 2Cl2+Si![]() SiCl4 平衡气压 浓硫酸 干燥氯气 四氯化硅沸点低,需要冷凝收集 Al、P 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
SiCl4 平衡气压 浓硫酸 干燥氯气 四氯化硅沸点低,需要冷凝收集 Al、P 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,E装置收集四氯化硅,F装置吸收空气中的水蒸气,防止四氯化硅接触水会发生化学反应,据此解答。
(1)装置A制备氯气,实验室利用浓盐酸和二氧化锰加热制备氯气,则其中发生反应的离子方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,D中发生Si与氯气的反应生成四氯化硅,则D中发生反应的化学方程式为2Cl2+Si
MnCl2+Cl2↑+2H2O,D中发生Si与氯气的反应生成四氯化硅,则D中发生反应的化学方程式为2Cl2+Si![]() SiCl4。
SiCl4。
(2)A中g管可以使内外压强相等,便于液体顺利流下;生成的氯气中混有氯化氢和水蒸气,首先利用饱和食盐水除去氯化氢,最后干燥氯气,则装置C中的试剂是浓硫酸,作用是干燥氯气。
(3)根据表中数据可知四氯化硅沸点低,因此装置E中的h瓶需要冷却的理由是冷凝收集四氯化硅。
(4)根据表中数据可知BCl3、FeCl3、PCl5的熔点很低,则精馏后的残留物中,除铁元素外可能还含有的杂质元素是B、P。
(5)过量的氯气可以用石灰乳来处理,该反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:![]()
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A. ①②⑤ B. ①④⑥⑦ C. ②③④⑥ D. ②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关物质的用途叙述错误的是( )
A.Ca(ClO)2用于消毒杀菌B.用铝制容器盛装稀硫酸
C.Fe2O3用于炼铁D.氧化镁作耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5min后,电极5的质量增加2.16g。假设电解过程中溶液的体积不变。

请回答下列问题:
(1)电源中a是_______极。A池中阳极的电极反应式为___________,C池中阴极的电极反应式为___________________________。
(2)通电5min后,如果B槽中共收集到224mL气体(标准状况),且溶液体积为200mL,则通电前溶液中Cu2+的物质的量浓度为___________________。
(3)如果A池溶液是200mL食盐水(假设电解液足量),则通电5min后,溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体分子且键角都为109°28′
C. NaCl晶体中与每个Na+距离相等且最近的Na+共有8个
D. 单质的晶体中一定不存在的微粒是阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。

(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体试样A是由一定量的Al、Mg均匀组成的混合物,为验证混合物的组成,进行如下实验:
①取m g试样A,全部溶于0.5L 2mol·L-1稀硫酸溶液中,放出11.2 L气体(已换算成标准状况),同时生成溶液B;
②另取m g试样A,加入2mol·L-1的NaOH溶液,当加到100mL时,气体不再生成;
③往溶液B中加入2mol/L NaOH,至沉淀不再发生变化。
根据以上过程回答下列问题:
(1)溶液B中是否含有H+_____________(填“是”或“否”);
(2)写出②中发生反应的离子方程式____________________________________;
(3)下列能表示过程③产生的沉淀质量W与加入NaOH溶液体积V的关系是_____;
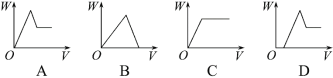
(4)m g试样A中含Mg的质量为________g;
(5)林同学通过查阅资料,发现浓硫酸与铝发生钝化,但与Mg能剧烈反应生成SO2,如果忽略钝化的反应过程,可以通过测定浓硫酸与固体试样反应产生的气体体积,来确定混合物A中镁的质量分数。
郭同学认为林同学的方案可行,但考虑到如果反应结束后硫酸未保持“浓”的状态,测定结果会____________(填“偏大”、“偏小”或“不变”),其依据是_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com