
【题目】下列微粒中,最外层未成对电子数最多的是( )
A. SB. AsC. MnD. Fe3+
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图________________________。
(2)元素X与元素Z相比,非金属性较强的是________(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:________________________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为____________________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,写出Q的电子式________。元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的、且在自然界中稳定存在的物质,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A. KH2PO4溶于水:H2PO4-![]() 2H++PO43-
2H++PO43-
B. NaHS溶于水:NaHS===Na++HS-,HS-![]() H++S2-
H++S2-
C. HF溶于水:HF===H++F-
D. NH4Cl溶于水:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=11,求强碱与强酸的体积比(溶液的体积变化忽略不计)是________________。
(2)取浓度相同的NaOH和HCl溶液,以3 :2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度(溶液的体积变化忽略不计)为__________________。
(3)常温下,PH=11的NH3·H2O与PH=3的盐酸等体积混合,混合溶液中,离子浓度关系为_________________________________________。
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+) : c(Cu2+) =___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
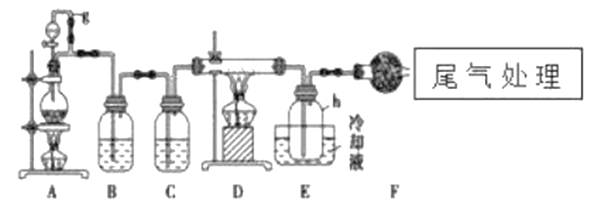
相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BC13 | A1C13 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:___________,D中发生反应的化学方程式___________。
(2)A中g管的作用是__________________,装置C中的试剂是___________,作用是___________。
(3)装置E中的h瓶需要冷却的理由是______________________。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是___________(填写元素符号)。
(5)过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
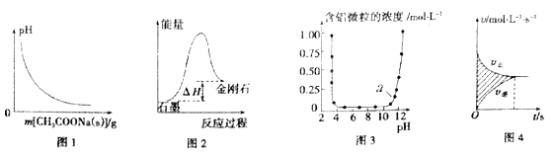
A. 图1表示向0.1mol/L CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图2表示石墨转化为金刚石反应过程中的能量变化,可判断石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 图4表示某可逆反应的v-t曲线,图中阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水发生反应,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示。下列说法正确的是:
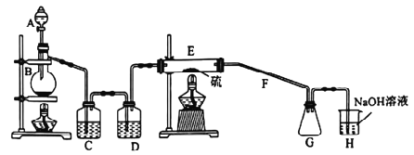
A. 实验时需先点燃E处的酒精灯
B. 二氯化二硫(S2Cl2)与水反应的产物为:S、H2S、HCl
C. C、D中所盛试剂依次为饱和氯化钠溶液、浓硫酸
D. G中可收集到纯净的产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产.
I.CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
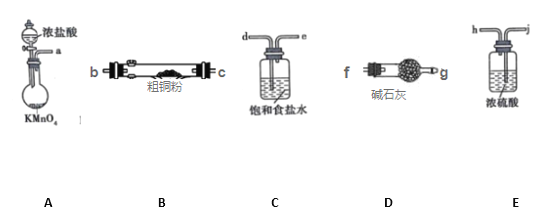
(1)写出装置A中,发生反应的化学反应方程式:_______________________________,装置C的作用是_______________________________
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→_________________________。(每种仪器限使用一次)
(3)上述D装置的作用是____________________
(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入_________,并过滤。
A.Cu B.CuCO3 C.CuO D.NaOH
ⅡCuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:_______________________________ 。
方法二 铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是_______________,当观察到_________________________________________________________________________________现象,即表明反应已经完全。
(2)②中,加入大量水的作用是______________。(从平衡角度解释)
(3)溶液中氯离子浓度达到一定量时,生成CuCl会部分溶解生成CuCl2-在一定温度下建立两个平衡: Cu Cl(s)![]() Cu+(aq) + Cl-(aq) Ksp=1.4x10-6 Cu Cl(s) + Cl一(aq)
Cu+(aq) + Cl-(aq) Ksp=1.4x10-6 Cu Cl(s) + Cl一(aq)![]() CuCl2-(aq) K=0.35
CuCl2-(aq) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2-]的函数关系曲线(要求至少标出曲线上一个坐标点)
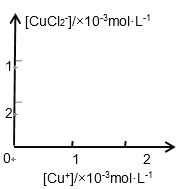 _______________
_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够鉴定氯乙烷中氯元素的存在的操作是
A. 在氯乙烷中直接加入AgNO3溶液
B. 在氯乙烷中加蒸馏水,然后加入AgNO3溶液
C. 在氯乙烷中加入乙醇,加热,然后加入AgNO3溶液
D. 在氯乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com