
【题目】下列电离方程式正确的是
A. KH2PO4溶于水:H2PO4-![]() 2H++PO43-
2H++PO43-
B. NaHS溶于水:NaHS===Na++HS-,HS-![]() H++S2-
H++S2-
C. HF溶于水:HF===H++F-
D. NH4Cl溶于水:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转换关系 (部分反应中得水已忽略)

(1)若A为氯碱工业的产品,C为厨房中的用品。
①反应Ⅰ的离子方程式为____________________________________________;
②氯碱工业制备A的化学方程式是__________________________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①B溶液可净水的原因是____________________________________________;
②A的实验制法的化学方程式____________________________________________。
(3)若B是一种两性氢氧化物,请写出反应Ⅲ的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答下列问题:
(1)工业冶炼铝的化学方程式是_________________。阴极反应式:__________。
若阳极转移电子0.6 mol生成Al的质量是________ g。
(2)铝与氢氧化钾溶液反应的离子方程式是_____________________________。
(3)工业产品氢氧化钾的溶液中含有某些含氧酸根离子,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),工作原理如下图所示。
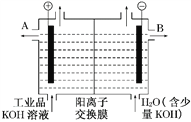
①该电解槽的阳极反应是__________________。
②通电开始后,阴极附近溶液pH会增大,原因为___________________________
③除去杂质后的氢氧化钾溶液从液体出口________(填“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关物质的用途叙述错误的是( )
A.Ca(ClO)2用于消毒杀菌B.用铝制容器盛装稀硫酸
C.Fe2O3用于炼铁D.氧化镁作耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工厂采用含硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3 mol/L,氢氟酸的浓度为8 mol/L。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol/L,硫酸的浓度为1 mol/L。现要用此回收酸液配制上述萃取液,在400 L回收酸液中加入________________L(小数点后保留一位有效数字)密度为1.84 g/cm3、浓度为98%的浓硫酸,然后 ________,即可得到符合要求的萃取液。
II.某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
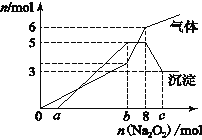
(1)该溶液中一定含有的阳离子是____________________,其对应物质的量浓度之比为___________________________,溶液中一定不存在的阴离子是_________________________。
(2)写出沉淀减少的离子方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com