
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水发生反应,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示。下列说法正确的是:
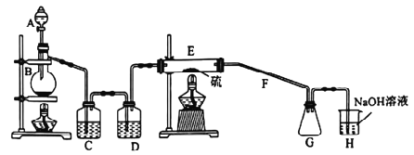
A. 实验时需先点燃E处的酒精灯
B. 二氯化二硫(S2Cl2)与水反应的产物为:S、H2S、HCl
C. C、D中所盛试剂依次为饱和氯化钠溶液、浓硫酸
D. G中可收集到纯净的产品
【答案】C
【解析】
由制备实验装置可知,A中为浓盐酸,B中为二氧化锰,浓盐酸与二氧化锰加热发生反应生成氯气,C中饱和食盐水除去HCl,D中浓硫酸干燥氯气,E中S与氯气反应生成S2Cl2,G中可收集液态S2Cl2,且可防止倒吸,H中NaOH溶液吸收尾气,
A、实验时需先点燃B处的酒精灯,后点燃E处的酒精灯,防止S与氧气反应,故A错误;
B、2S2Cl2+2H2O=SO2↑+3S↓+4HCl,二氯化二硫(S2Cl2)与水反应的产物为:S、SO2、HCl,故B错误;
C、C中饱和食盐水除去HCl,D中浓硫酸干燥氯气,故C正确;
D、G收集产品,H中氢氧化钠溶液中水蒸气易挥发,进入G中,易使S2Cl2水解,在G和H之间增加干燥装置,否则G中可不收集到纯净的产品,故D错误;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答下列问题:
(1)工业冶炼铝的化学方程式是_________________。阴极反应式:__________。
若阳极转移电子0.6 mol生成Al的质量是________ g。
(2)铝与氢氧化钾溶液反应的离子方程式是_____________________________。
(3)工业产品氢氧化钾的溶液中含有某些含氧酸根离子,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),工作原理如下图所示。
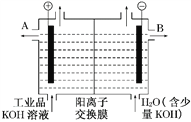
①该电解槽的阳极反应是__________________。
②通电开始后,阴极附近溶液pH会增大,原因为___________________________
③除去杂质后的氢氧化钾溶液从液体出口________(填“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关物质的用途叙述错误的是( )
A.Ca(ClO)2用于消毒杀菌B.用铝制容器盛装稀硫酸
C.Fe2O3用于炼铁D.氧化镁作耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体分子且键角都为109°28′
C. NaCl晶体中与每个Na+距离相等且最近的Na+共有8个
D. 单质的晶体中一定不存在的微粒是阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O = NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ ;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22—的空间构型为________。
(2)三聚氰胺(![]() )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为_______,O2-处于Ca2+堆积形成的空隙中;CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是__________。

(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工厂采用含硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3 mol/L,氢氟酸的浓度为8 mol/L。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol/L,硫酸的浓度为1 mol/L。现要用此回收酸液配制上述萃取液,在400 L回收酸液中加入________________L(小数点后保留一位有效数字)密度为1.84 g/cm3、浓度为98%的浓硫酸,然后 ________,即可得到符合要求的萃取液。
II.某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
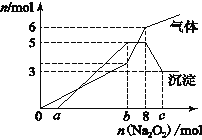
(1)该溶液中一定含有的阳离子是____________________,其对应物质的量浓度之比为___________________________,溶液中一定不存在的阴离子是_________________________。
(2)写出沉淀减少的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4 是一种氧化剂,实验室常用 KMnO4和浓盐酸反应制备 Cl2。下图是制备 NaClO溶液的装置图。
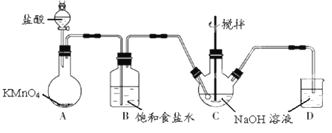
完成下列填空:
(1)KMnO4 稀溶液是一种常见消毒剂,其消毒机理与以下物质相似的是______(选填编号)。
a.75%酒精 b.双氧水 c.NaClO 溶液 d.硫磺皂
(2)B装置中饱和食盐水的作用是___________,D装置中NaOH的作用______________。
(3)实验操作过程中可调节__________以控制A 装置中产生 Cl2 的气流,C装置需控制反应温度在 0~5℃,实验中可将C 装置放入________________中。
II.测定 KMnO4纯度可用标准 Na2S2O3进行标定
(4)配制250 mL 0.1000 mol/L标准 Na2S2O3溶液,需准确称取Na2S2O3固体的质量为____g(精确到0.001)。
(5)取某 KMnO4 0.600g,酸化后用 0.1000 mol/L 标准 Na2S2O3溶液进行滴定,滴定至终点消耗 Na2S2O3溶液 20.00 mL,则该 KMnO4 产品的纯度是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com