
����Ŀ��KMnO4 ��һ����������ʵ���ҳ��� KMnO4��Ũ���ᷴӦ�Ʊ� Cl2����ͼ���Ʊ� NaClO��Һ��װ��ͼ��
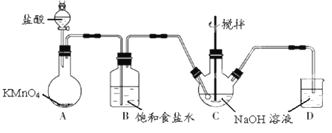
���������գ�
(1)KMnO4 ϡ��Һ��һ�ֳ����������������������������������Ƶ���______(ѡ����)��
a.75%�ƾ� b.˫��ˮ c.NaClO ��Һ d.�����
(2)Bװ���б���ʳ��ˮ��������___________��Dװ����NaOH������______________��
(3)ʵ����������пɵ���__________�Կ���A װ���в��� Cl2 ��������Cװ������Ʒ�Ӧ�¶��� 0~5�棬ʵ���пɽ�C װ�÷���________________�С�
II.�ⶨ KMnO4���ȿ��ñ� Na2S2O3���б궨
(4)����250 mL 0.1000 mol/L�� Na2S2O3��Һ����ȷ��ȡNa2S2O3���������Ϊ____g����ȷ��0.001����
(5)ȡij KMnO4 0.600g���ữ���� 0.1000 mol/L �� Na2S2O3��Һ���еζ����ζ����յ����� Na2S2O3��Һ 20.00 mL����� KMnO4 ��Ʒ�Ĵ�����_________
���𰸡� bc �� HCl β�����������ն���Cl2 ��Һ©����������� ��ˮԡ 3.950 84.3��
������������ʵ�鷽����������ۣ���1��KMnO4������������������KMnO4��ǿ�����ԣ�a��75%�ƾ�������ǿ�����ԣ�����������KMnO4��ͬ����a����b��˫��ˮ����ǿ�����ԣ�������ǿ�����Խ�������������������KMnO4���ƣ���b��ȷ��c��NaClO����ǿ�����ԣ�������ǿ�����Խ�������������������KMnO4���ƣ���c��ȷ��d�������������ǿ�����ԣ�����������KMnO4��ͬ����d����2��Aװ�ò��������к���HCl��HCl����NaOH��Ӧ��ʹ����NaClO�Ĵ��Ƚ��ͣ������ȥHCl����˱���ʳ��ˮ��Ŀ���dz�ȥ�����л���HCl����Ϊ�����ж���Ϊ��ֹ��Ⱦ�����������ȥδ��Ӧ�����������װ��D��������β�����������ն������������3�����Ʋ�������������������ڷ�Һ©���Ļ����������Ƶ�����ƿ�������ٶȣ���Ϊ�������������Ʒ�Ӧ�¶Ƚϸ�ʱ������NaClO3�������Ҫ�����¶ȣ������¶���0��5�棬�ɽ�Cװ�÷����ˮԡ�У���4����Ҫ����Na2S2O3������Ϊ250��10��3��0.1��158g=3.950g����5�����ݵ�ʧ������Ŀ�غ㣬20.00��10��3��0.1��2��4=n(KMnO4)��5�����n(KMnO4)=3.2��10��3mol��������Ϊ3.2��10��3��158g=0.5056g����Ʒ�Ĵ���Ϊ0.5056/0.600��100%=84.3%��


 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����Ȼ�����(S2Cl2)Ϊ�Ȼ�ɫҺ�壬��ˮ������Ӧ����ҵ����������ijѧϰС�������������ʺϳ�S2Cl2��ʵ��װ����ͼ��ʾ������˵����ȷ���ǣ�
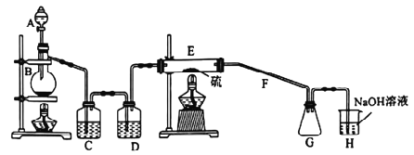
A. ʵ��ʱ���ȵ�ȼE���ľƾ���
B. ���Ȼ�����(S2Cl2)��ˮ��Ӧ�IJ���Ϊ:S��H2S��HCl
C. C��D����ʢ�Լ�����Ϊ�����Ȼ�����Һ��Ũ����
D. G�п��ռ��������IJ�Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�Ӻ���3p�Dz��еĵ��ӣ�����ͬ����
A. ��������չ����B. ��������״
C. ����D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ���������������Ԫ�صĴ��ڵIJ�����
A. ����������ֱ�Ӽ���AgNO3��Һ
B. ���������м�����ˮ��Ȼ�����AgNO3��Һ
C. ���������м����Ҵ������ȣ�Ȼ�����AgNO3��Һ
D. ���������м���NaOH��Һ�����Ⱥ��ữ��Ȼ�����AgNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������ѵ���ԭ�� NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)+Q(Q>0)
��1���÷�Ӧ��ѧƽ�ⳣ�� K �ı���ʽΪ_____________________�����ƽ�ⳣ�� K ֵ����_______(�����Ӧ�����淴Ӧ��)������Ӱ�����
��2������Ӧ�ں��������½��У���˵����Ӧ�Ѿ��ﵽƽ��״̬����______(�����)
a�������ڻ�������������
b�������������ѹǿ����
c����Ӧ���� 0.5mol NO ��ͬʱ���� 1mol N2 d��NO2 ��Ũ�Ȳ���
��3���� 2 L �ܱ������м��뷴Ӧ�10 min ��ﵽƽ�⣬���ƽ��ʱ��������ʵ��������� 0.2mol������H2O(g)��ʾ��ƽ����Ӧ����Ϊ__________________��
��4����ͼ�� P1 ѹǿ�� NO ��ת�����淴Ӧʱ��(t)�ı仯ͼ������ͼ�л�������������������£�ѹǿΪP2(P2> P1)�� NO ��ת�����淴Ӧʱ��仯��ʾ��ͼ________________��

��5��д����Ӧ���еİ����ĵ���ʽ______����ռ乹��Ϊ______������������������ NH4Cl��NH4Cl ��Һ��_____________�ԣ������½��������Ũ�ȵİ�ˮ��NH4Cl��Һ��ϣ�pH>7����Һ�� NH3��H2O��H+��OH����NH4+��Cl һŨ���ɴ�С�Ĺ�ϵ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʵ��ʱӦǿ����ȫ��ʶ������������ȷ���ǣ�������
A.�������Ż�ʱʹ����ĭ��������
B.���Թܼ���̼�����ƹ���ʱʹ�Թܿ���ֱ����
C.Ũ���ὦ��Ƥ����ʱ������ϡ����������Һ��ϴ
D.ϡ��Ũ����ʱӦ��Ũ���������ձ��ڱ���������ˮ�У������Ͻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ӷ�Ӧ����
A.H2��O2��Ӧ����ˮB.пƬͶ��ϡ������
C.˫��ˮ(H2O2)�ֽ���ȡO2D.��¯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�У���ȷ����( )
A. �����ȼ����Ϊ 890.3 kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ�� CH4(g)+2O2(g)=CO2(g)+2H2O(g)��H=-890.3 kJ/mol
B. 500�桢30MPa �£��� 0.5mol N2�� 1.5molH2�����ܱ������г�ַ�Ӧ���� NH3(g)������ 19.3 kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2(g) ![]() 2NH3(g) ��H = -38.6 kJ/mol
2NH3(g) ��H = -38.6 kJ/mol
C. ϡ����� ϡ����������Һ��ϣ� ���Ȼ�ѧ����ʽΪ��H+(aq)+OH-(aq)=H2O(1) ��H = -57.3 kJ/mol
D. 1molH2��ȫȼ�շ��� 142.9kJ��������ȼ�յ��Ȼ�ѧ����ʽΪ�� 2H2(g)+O2(g)=2H2O(1)��H =+285.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������-������ؾ��������ܶȸߵ��ŵ㣬������������Դ�����ĵ�Դ����ṹ��ͼ��ʾ�����й�������ֻ����Li+ͨ��������˵����ȷ����
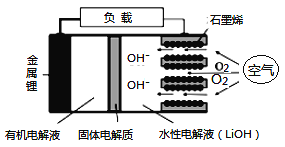
A. Li+�������������������ƶ����õ�LiOH��Һ
B. �ŵ�ʱ�������·����1 mol e��ת��ʱ��ˮ�Ե��Һ������������NA
C. Ӧ�øõ�ص��ͭ��������������64 g�������Ͻ�����11.2 L O2
D. �ŵ�ʱ��������Ӧʽ��Li��e����OH����LiOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com