
【题目】在1L氯化铁和氯化铝的混合液中,Fe3+的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为1.8 mol/L。要使Fe3+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为( )
A. 450mL B. 500mL C. 300mL D. 200mL
【答案】B
【解析】
根据氯化铁和AlCl3的混合溶液与碱的反应可知,要使Fe3+全部转化为沉淀分离出来,Al3+需要恰好转化为AlO2-,可以先利用电荷守恒来计算Al3+的浓度,再根据反应方程式计算。
FeCl3和AlCl3的混合溶液,其中Fe3+的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为1.8mol/L,设Al3+的浓度为x,由电荷守恒可知,0.4mol/L×1L×3+x×1L×3=1.8mol/L×1L×1,解得x=0.2mol/L,则Fe3+、Al3+的物质的量分别为1L×0.4mol/L=0.4mol、1L×0.2mol/L=0.2mol,
FeCl3 + 3NaOH=Fe(OH)3↓+3NaCl
1 3
0.4mol 1.2mol
AlCl3 + 4NaOH=NaAlO2+3NaCl+2H2O,
1 4
0.2mol 0.8mol
使Fe3+全部转化为沉淀分离出来,消耗的NaOH的物质的量为1.2mol+0.8mol=2mol,则需加4molL-1NaOH溶液的体积为![]() =0.5L=500mL,故选B。
=0.5L=500mL,故选B。


科目:高中化学 来源: 题型:
【题目】下列物质中能与醋酸发生反应的是
①石蕊 ②乙醇 ③溴乙烷 ④金属铝 ⑤氧化镁 ⑥碳酸钙 ⑦氢氧化铜 ⑧苯
A.①④⑤⑥⑦⑧ B.②③④⑤⑧ C.①②④⑤⑥⑦ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上烟气脱氮的原理 NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数 K 的表达式为_____________________。如果平衡常数 K 值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变
b.容器内气体的压强不变
c.反应消耗 0.5mol NO 的同时生成 1mol N2 d.NO2 的浓度不变
(3)向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测得平衡时气体的物质的量增加了 0.2mol,则用H2O(g)表示的平均反应速率为__________________。
(4)如图是 P1 压强下 NO 的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2> P1)下 NO 的转化率随反应时间变化的示意图________________。

(5)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥 NH4Cl。NH4Cl 溶液显_____________性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中 NH3·H2O、H+、OH-、NH4+、Cl 一浓度由大到小的关系是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应利用”实验,并检验产物的性质:
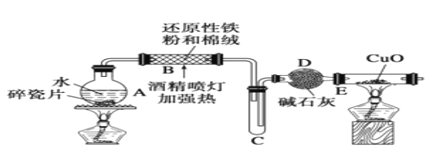
(1)B中与水蒸气发生反应的化学方程式为_____________________.
(2)D中碱石灰的作用是_____________________.
(3)E中实验现象是______________________.
(4)上述实验结束后,取出B中铁粉反应后的少量固体继续进行如下实验:
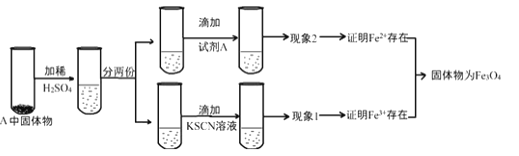
①B中产物与稀硫酸发生的离子方程式为:______________。
②试剂A是_________________(选填字母)。
NaOH溶液 b酸性KMnO4溶液 c.酚酞d.氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为_______(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
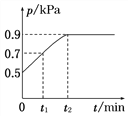
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com