
【题目】在甲、乙两个恒容的密闭容器中进行下列两个可逆反应:甲容器中![]() ;乙容器中
;乙容器中![]() 。现有下列状态:①混合气体的平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体的浓度相等;④反应体系中温度保持不变(假设为绝热容器);⑤相同时间内,断裂H—O键的速率是断裂H-H键速率的2倍;⑥混合气体密度不变;⑦单位时间内,消耗水蒸气的质量与生成氢气的质量之比为9:1。其中能表明甲、乙两容器中反应都达到平衡状态的是( )
。现有下列状态:①混合气体的平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体的浓度相等;④反应体系中温度保持不变(假设为绝热容器);⑤相同时间内,断裂H—O键的速率是断裂H-H键速率的2倍;⑥混合气体密度不变;⑦单位时间内,消耗水蒸气的质量与生成氢气的质量之比为9:1。其中能表明甲、乙两容器中反应都达到平衡状态的是( )
A. ①②B. ③④⑥C. ⑥⑦D. ④⑤
【答案】D
【解析】
①混合气体平均相对分子质量不再改变,由于乙反应前后气体的分子数保持不变,气体的物质的量始终不变,质量也不变,所以平均相对分子质量始终不变,无法判断乙反应是否达到平衡状态,故①错误;
②恒温时,气体压强不再改变,乙反应前后气体的分子数保持不变,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,故②错误;
③各气体的浓度相等,不能判断各组分的浓度不变,无法判断达到平衡状态,故③错误;
④绝热容器中,反应体系中温度保持不变,说明正逆反应速率相等,达到了平衡状态,故④正确;
⑤断裂氢氧键速率是断裂氢氢键速率的2倍,说明正逆反应速率相等,达到了平衡状态,故⑤正确;
⑥由于容器的容积不变,气体的质量不变,所以密度始终不变,无法判断乙是否达到平衡状态,故⑥错误;
⑦单位时间内,消耗水质量与生成氢气质量比为9∶1,水与氢气的物质的量之比为1∶1,表示的都是正反应速率,无法判断正逆反应速率是否相等,不能说明达到平衡状态,故⑦错误;
故选D。


科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
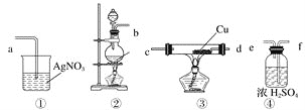
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第19届亚洲运动会将于2022年在杭州举行,杭州的空气与水质量的提高越来越成为人们关注的问题。其中,烟气中的NOx与水中总氮含量(包括有机氮及NO3-、NO2-、NH4+等无机氮)都必须脱除(即脱硝)后才能排放。请回答下列问题:
I.空气的脱硝处理:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3.kJ· mol-1
N2(g)+O2(g)=2NO(g) ΔH2= +180.kJ· mol-1
(1)CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)![]() CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
A.甲烷过量,可将NO完全转化为N2
B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变
D.平衡后,再通入一定量的甲烷,正反应速率增大
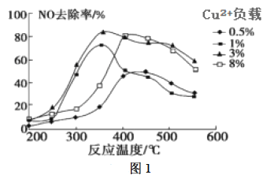
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是____。

II.水的脱硝处理:
(3)水中的含氮物质在好氧硝化菌的作用下有如下反应:
2NH4+(aq)+3O2(g)=2NO2-(aq)+4H+(aq)+2H2O(l)(快反应)
2NO2-(aq)+O2(g)=2NO3-(aq)(慢反应)
20℃时含氮废水(以NH4+)的NH4+的浓度随DO(水体中溶解氧)浓度的变化曲线如图2所示,在图2上画出20℃时NO2-的浓度随DO的变化趋势图。_______
(4)研究表明,用电解法除去氨氮废水(反应中视为NH4+)有很高的脱氮(转化为N2)效率,写出该过程中阳极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
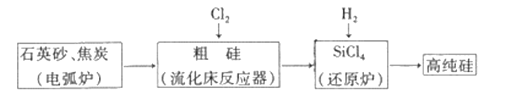
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于指定粒子构成的几种描述中正确的是
A.![]() C与
C与![]() C是不同的核素,所以分别由这两种原子构成的石墨化学性质不同
C是不同的核素,所以分别由这两种原子构成的石墨化学性质不同
B.H2O和D2O是同分异构体
C.H3O+与-OH具有相同的电子数
D.37Cl与39K具有相同的中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1,Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:
(1)CO的燃烧热ΔH=_______________。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:________。
(3)工业废气中的CO2可用碱液吸收,所发生的反应如下:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1,CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-bkJ·mol-1,则:
①CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②标况下,11.2LCO2与足量的NaOH溶液充分反应后,放出的热量为_______kJ(用含a或b的代数式表示)。
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H18O2的有机物A有下列转化关系

其中B、C的相对分子质量相等,则A的可能结构有
A. 16种 B. 10种 C. 8种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(Bisphenol A dimethacrylate)是一种交联单体。合成F的一种路线如图:
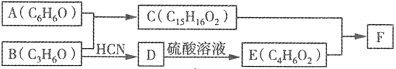
已知:① +HCN
+HCN
②B不能发生银镜反应。
③C能与FeCl3发生显色反应,核磁共振氢谱显示有4种不同化学环境的氢。
④E既能使溴水褪色又能使石蕊试液显红色。
⑤1 mol F最多可与4 mol NaOH反应。
回答下列问题:
(1)A与B反应的化学方程式为_______。
(2)B→D的反应类型为_____,E的结构简式为______。
(3)F的结构简式为______。
(4)C的同分异构体中含有萘环(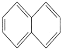 )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有_____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是_______(写出其中一种的结构简式)。
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有_____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是_______(写出其中一种的结构简式)。
(5)A经如下步骤可合成环己烯甲酸:

反应条件(包括反应试剂)1为_____;反应条件(包括反应试剂)2为______;反应条件3所选择的试剂为_______;I的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com