
【题目】短周期元素X,Y,Z组成的化合物Y2X和ZX2 , Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3 . 已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子的最外层电子数是次外层电子数的2倍.试回答:
(1)X,Y,Z元素的名称及符号.X:Y:Z:
(2)写出ZX2的化学式:
(3)写出Y2X对应水化物的电子式 , 并指出其中存在的化学键.
(4)写出Y2X溶于水的溶液与ZX2反应的化学方程式. .
【答案】
(1)氧(O);钠(Na);碳(C)
(2)CO2
(3)![]() ;离子键和共价键
;离子键和共价键
(4)2NaOH+CO2=Na2CO3+H2O
【解析】解:(1)由以上分析可知X为氧元素(O),Y为钠元素(Na),Z为碳元素(C),所以答案是:氧(O);钠(Na);碳(C);(2)X为氧元素(O),Z为碳元素(C),ZX2的化学式为CO2 , 所以答案是:CO2;(3)化合物Y2X对应的水化物为NaOH,其电子式为 ![]() ,存在的化学键有离子键和共价键, 所以答案是:
,存在的化学键有离子键和共价键, 所以答案是: ![]() ;离子键和共价键;(4)NaOH溶液与二氧化碳反应生成碳酸钠,化学方程式为2NaOH+CO2=Na2CO3+H2O,所以答案是:2NaOH+CO2=Na2CO3+H2O.
;离子键和共价键;(4)NaOH溶液与二氧化碳反应生成碳酸钠,化学方程式为2NaOH+CO2=Na2CO3+H2O,所以答案是:2NaOH+CO2=Na2CO3+H2O.


科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
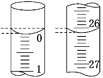
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______mL,终点读数为_______mL,所用盐酸溶液的体积为_______mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g)![]() PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
A. 10 min内,v(Cl2) = 0.04 mol/(L·min)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的![]()
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途中,运用了物质的化学性质的是
A. 用胶状氢氧化铝凝聚水中的悬浮物进行净水
B. 用红棕色氧化铁制造红色油漆
C. 氢氧化铝作为医用的胃酸中和剂
D. 用氧化铝制造耐火坩埚和耐火管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是
A. 硅酸钠
B. 碳酸钠,硅酸钠
C. 碳酸钠,二氧化硅
D. 二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有四个药品橱,已存放如下药品:
橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
药品 | 盐酸、硫酸 | CCl4、C2H5OH | 红磷、硫 | 铜、锌 |
实验室新购进一些活性炭,应将它存放在
A. 甲橱 B. 乙橱 C. 丙橱 D. 丁橱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
实验 序号 | 温度/℃ | 时间/min | ||||||
0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验l过程中,10 min~20 min时间内用B表示该反应的平均化学反应速率为_________mol/(L·min)。
(2)在实验2过程中,A的初始浓度c2=______mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________________________。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3_____v1,且c3________1.0 mol/L (填“<”、“>”或“=”)。
(4)比较实验4和实验l,可推测该反应是___________反应(填“吸热”或“放热”)。理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)下列反应中,属于放热反应的是 , 属于吸热反应的是(填序号). ①煅烧石灰石②木炭燃烧③炸药爆炸④酸碱中和⑤生石灰与水作用制熟石灰⑥消石灰与氯化铵制备氨气
(2)用锌片、铜片连接后浸入硝酸银溶液中,构成了原电池,此电池的负极是 , 电路中电子的流向是 , (填“从锌到铜”或者“从铜到锌”),正极的电极反应式是 . 工作一段时间,锌片的质量减少了3.25g,则铜表面析出了银g,导线中通过mol电子.
(3)某化学反应,设反应物的总能量为E1 , 生成物的总能量为E2 , 若E1>E2 , 则该反应为热反应,中和反应都是热反应,其实质是 . (用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com