
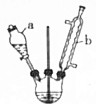
 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下: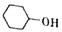 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O分析 (1)仪器b的名称为:球形冷凝管,起冷凝、回流作用;通过分液漏斗加入液体时,首先打开分液漏斗上口的塞子,保证内外压强一致;
(2)向三颈瓶种快速一次性加入环己醇,环己醇挥发;发烟硝酸易分解,反应物减少;
(3)在此反应过程中利用了硝酸的强氧化性氧化环己醇得到己二酸,故偏钒酸铵的作用是催化剂;
(4)从题目中信息可知己二酸随着温度的降低溶解度减小;
(5)尾气的成分为一氧化氮和氧气,与烧碱反应生成硝酸钠;
(6)根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)仪器b的名称为:球形冷凝管,冷水从冷凝管下口入,上口出,起冷凝、回流作用;向三颈瓶中加入环己醇的操作是先打开分液漏斗上口的塞子,再打开活塞,缓慢滴入环己醇;
故答案为:起冷凝、回流作用;先打开分液漏斗上口的塞子,再打开活塞,缓慢滴入环己醇;
(2)向三颈瓶种快速一次性加入环己醇,环己醇挥发,产率会减小;本实验若用发烟硝酸替代50%硝酸,发烟硝酸易分解,反应物减少,产率会减小;
故答案为:减小;减小;
(3)在此反应过程中利用了硝酸的强氧化性氧化环己醇得到己二酸,故偏钒酸铵的作用是催化剂,提高合成产品的速率;
故选C.
(4)己二酸随着温度的降低溶解度减小,故用“冷水”洗涤己二酸减少溶解;
故答案为:己二酸随着温度的降低溶解度减小,用“冷水”洗涤己二酸减少溶解,热水洗涤己二酸会溶解;
(5)尾气的成分为一氧化氮和氧气,与烧碱反应生成硝酸钠,方程式为:4NO+3O2+4NaOH=4NaNO3 +2H2O,离子方程式:4NO+3O2+4OH-=4NO3-+2H2O;
故答案为:4NO+3O2+4OH-=4NO3-+2H2O;
(6)16.0mL 50% 硝酸(ρ=1.31g•cm-3)的物质的量为$\frac{16.0mL×1.31g•c{m}^{-3}×50%}{63g/mol}$=0.166mol,5.3mL环己醇的物质的量为$\frac{5.3mL×0.9624g•c{m}^{-3}}{100g/mol}$=0.051mol,由根据方程式3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O可知环己醇不足,生成的HOOC(CH3)4COOH的物质的量为0.051mol,质量为0.051mol×150g/mol=7.65g,所以己二酸的产率为$\frac{5.6g}{7.65g}$×100%=73.2%;
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O可知环己醇不足,生成的HOOC(CH3)4COOH的物质的量为0.051mol,质量为0.051mol×150g/mol=7.65g,所以己二酸的产率为$\frac{5.6g}{7.65g}$×100%=73.2%;
故答案为:73.2%;
点评 本题考查了化学基本仪器的使用,化学实验基本操作方法,产率的计算以及利用方程式的有关计算等,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
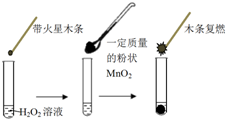 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
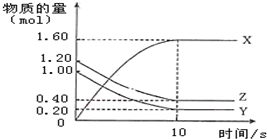 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.04 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度增加了0.8 mol/L | |
| C. | 反应开始到10s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:4Z(g)+5Y(g)═8X(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
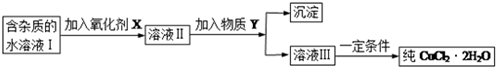
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | 氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO | |
| C. | 元素的性质呈现周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 | |
| D. | 稀有气体一般难于发生化学反应,是由于其键能大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com