
分析 (1)浓硫酸具有吸水性,所以常用浓H2SO4作气体干燥剂;
(2)依据浓硫酸、浓硝酸都具有强的氧化性解答;金属铜与稀硝酸反应的离了方程式是8H++2NO3-+3Cu═3Cu2++2NO↑+4H2O;生成标准状况下11.2L气体,物质的量为0.5mol,所以转移电子的物质的量为:0.5mol×3=1.5mol.
解答 解:(1)浓硫酸具有吸水性,所以常用浓H2SO4作气体干燥剂,故答案为:吸水性;
(2)浓硫酸、浓硝酸都具有强的氧化性,常温下能够使铁、铝钝化,形成致密氧化膜阻止反应进行,所以可以用铝、铁的容器盛装,金属铜与稀硝酸反应的离了方程式是8H++2NO3-+3Cu═3Cu2++2NO↑+4H2O;生成标准状况下11.2L气体,物质的量为0.5mol,所以转移电子的物质的量为:0.5mol×3=1.5mol,
故答案为:它们表面被氧化为致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应;8H++2NO3-+3Cu═3Cu2++2NO↑+4H2O;1.5.
点评 本题考查了元素化合物知识,侧重考查浓硫酸、浓硝酸的性质,熟悉浓硫酸、浓硝酸的强的氧化性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K越大,达到平衡时,反应进行的越完全 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L碳酸钠溶液中含有lmolNa+ | |
| B. | 14g氮气和一氧化碳混合气体中含原子总数为NA | |
| C. | 标准状况下,2.24LCCl4物质的量为0.1mol | |
| D. | 56g铁溶于过量的盐酸,电子转移数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO4、Na2SO3、NaHSO3 | SO3、X、Na2SO4、NaHSO4 |
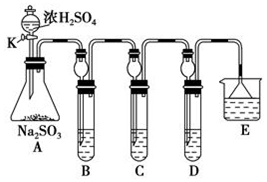
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 熵增且焓减的反应一定是自发的 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发反应 | |
| D. | 自发反应一定是熵增加的,熵减小的反应都是非自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 450mL,52.65g | B. | 500mL,58.5g | C. | 450mL,117g | D. | 500mL,52.3g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com