
���� ��1����ͭ��Ũ���ᷴӦ��������ͭ������������ˮ��
��ͭ��ϡ���ᷴӦ��������ͭ��һ��������ˮ��
�����Ի�������������Ӿ���ǿ�������ԣ�
��2�����ݷ�Ӧ3Cu+2NO3-+8H+=3Cu2++2NO+4H2O���жϹ������ٽ��м�����
��� �⣺��1����ͭ������Ũ���ᷴӦ�����ӷ���ʽΪ��Cu+4H++2NO3-�TCu2++2H2O+2NO2����
�ʴ�Ϊ��Cu+4H++2NO3-�TCu2++2H2O+2NO2����
��ͭ��ϡ���ᷴӦ��������ͭ��һ��������ˮ����Ӧ�����ӷ���ʽ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
�ʴ�Ϊ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
�۴���Ӧֹͣ����Һ�к���ͭ���ӣ���������ӣ��ټ���������25%��ϡ���ᣬ����Һ�к��������ӣ����Ի�������������Ӿ���ǿ�������ԣ��ܹ���������ͭ��
�ʴ�Ϊ���ټ���ϡH2SO4��H+��NO3-����������������
��2����ij100mL�����У���������ʵ���n��HNO3��=0.1L��0.4mol/L=0.04mol����������ʵ���n��H2SO4��=0.1L��0.2moL/L=0.02moL��
���������ӵ����ʵ���n��H+��=0.04moL+2��0.02moL=0.08mol��
ͭ�۵����ʵ���=$\frac{2.56g}{64g/mol}$=0.04mol�����ݷ���ʽ��
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2 8
0.04mol 0.04mol 0.08mol ��֪�����Ӳ��㣬�ʸ���H+���㣬�ɷ���ʽ��֪n��Cu2+��=$\frac{3}{8}$��0.08mol=0.03mol��
����C��Cu2+��=$\frac{0.03mol}{0.1L}$=0.3mol/L��
�ʴ�Ϊ��0.3mol/L��
���� ���⿼����Ũ��������ʼ��йؼ��㣬��Ϥ�����ǿ�������ǽ���ؼ�������ʱע���������ӷ�Ӧ����ʽ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
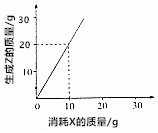
| A�� | ��4g Z����ʱ��������Y 3g | B�� | X��Y��Z��Ħ������֮��Ϊ1��1��2 | ||
| C�� | X��Y��Z��Ħ������֮��Ϊ2��3��2 | D�� | X��Y��Z��Ħ������֮��Ϊ3��2��6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S2+�ĵ���ʽΪ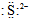 | B�� | ̼ԭ�ӵĵ���ʽ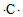 | ||
| C�� | ��ԭ�ӵĽṹʾ��ͼ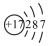 | D�� | F-�Ľṹʾ��ͼΪ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ļ������� CH2=CH2 һ������һ�������¿ɾۺϳɸ߷��ӻ�����㷺���� ũ�ñ�Ĥ�ľ�����ϩ���ϣ����� CH2=CH-Cl �ۺ϶��ɵģ��仯ѧ��Ӧ����ʽ��
�Ļ������� CH2=CH2 һ������һ�������¿ɾۺϳɸ߷��ӻ�����㷺���� ũ�ñ�Ĥ�ľ�����ϩ���ϣ����� CH2=CH-Cl �ۺ϶��ɵģ��仯ѧ��Ӧ����ʽ�� ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϴ�Ӻ������ƿδ���� | B�� | ��Һ��δϴ���ձ��Ͳ����� | ||
| C�� | ����ʱ���۾����߸��ӿ̶��� | D�� | ��Һʱ��������Һ������ƿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��H+��SO42-��OH- | B�� | Na+��Ca2+��CO32-��NO3- | ||
| C�� | Na+��H+��CO32-��Cl- | D�� | Na+��Cu2+��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com