
分析 纯碱中滴加盐酸,发生Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2 ↑+H2O,结合反应物的物质的量以及反应的化学方程式计算该题.
解答 解:n(Na2CO3)=0.01L×1mol/L=0.01mol,n(HCl)=0.01L×1.5mol/L=0.015mol,
首先发生Na2CO3+HCl=NaCl+NaHCO3
0.01mol 0.01mol 0.01mol
然后发生NaHCO3+HCl=NaCl+CO2 ↑+H2O
1mol 22.4L
0.015mol-0.01mol V
则V=$\frac{0.005mol×22.4L}{1mol}$=0.112L=112mL,
故答案为:112.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的化学反应及反应的先后顺序为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L碳酸钠溶液中含有lmolNa+ | |
| B. | 14g氮气和一氧化碳混合气体中含原子总数为NA | |
| C. | 标准状况下,2.24LCCl4物质的量为0.1mol | |
| D. | 56g铁溶于过量的盐酸,电子转移数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 熵增且焓减的反应一定是自发的 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发反应 | |
| D. | 自发反应一定是熵增加的,熵减小的反应都是非自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 450mL,52.65g | B. | 500mL,58.5g | C. | 450mL,117g | D. | 500mL,52.3g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
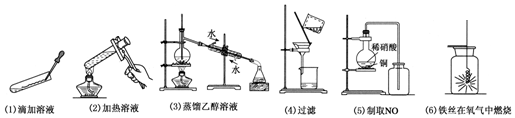
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.98 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
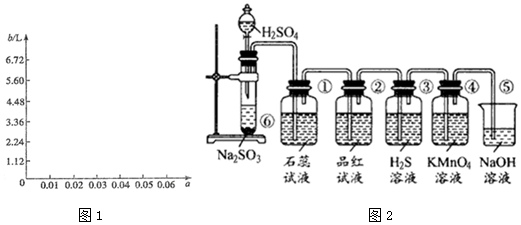
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl- 个数为NA | |
| B. | V mL硫酸铁溶液中含有mg SO42-,则Fe3+的物质的量浓度为6.94m/V mol•L-1 | |
| C. | 将58.5 g NaCl溶解于1 L水中配成溶液,所得溶液的物质的量浓度为1 mol•L-1 | |
| D. | 用36.5%的浓盐酸(密度为1.25g•cm-3)配制成浓度为0.1mol•L-1的稀盐酸240mL,所需浓盐酸的体积为1.9mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| B. | FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: +CO2+H2O→ +CO2+H2O→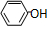 +HCO3- +HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com