
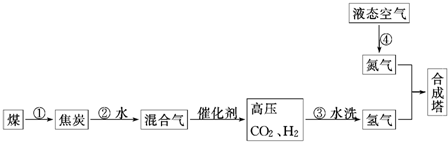
| ||
| ||
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 2x |
| a-x+4a-3x+2x |
| 0.5a |
| a |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、大量使用燃煤发电是形成雾霾的主要原因 |
| B、天然气、煤气大量泄漏遇到明火会爆炸 |
| C、利用化学反应可实现12C到14C的转化 |
| D、晶体硅可用于光伏发电、制造芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
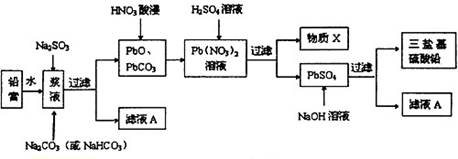
查看答案和解析>>
科目:高中化学 来源: 题型:
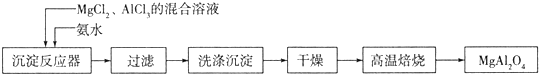
查看答案和解析>>
科目:高中化学 来源: 题型:
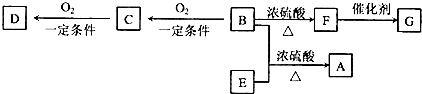
查看答案和解析>>
科目:高中化学 来源: 题型:
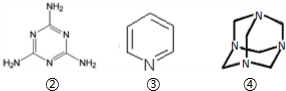 )
)| 实验序号 | 混合物 质量 | 物质的量关系n(Y)/n(Z) | 产物的量 | ||
| m(CO2)/g | m(H2O)/g | V(N2)/mL | |||
| ① | 3g | 2:3 | 3.08 | 1.8 | 672 |
| ② | 3g | 3:2 | 3.52 | 1.8 | 448 |
查看答案和解析>>
科目:高中化学 来源: 题型:
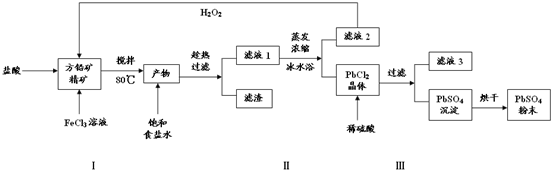
查看答案和解析>>
科目:高中化学 来源: 题型:
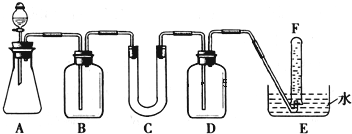
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com