
����Ŀ�����Ͳ�����dz��õĽ�����ʹҩ���һ�ֺϳ�·�����£�

��֪���� 
�� R1COOR2 + R3OH ![]() R1COOR3 + R2OH
R1COOR3 + R2OH
��1�����չ����ŷ��࣬A�����������______��
��2����Ӧ�ٵĻ�ѧ����ʽ��______��
��3���Լ�X�Ľṹ��ʽ��______��
��4��F��G�ķ�Ӧ������______��
��5��H�Ľṹ��ʽ��______��
��6����Ӧ�ڵĻ�ѧ����ʽ��______��
��7�����Ͳ�����ܻ���ˮ���ͷų�����ң��뽫���з���ʽ����������
 + 2n H2O
+ 2n H2O![]() ______
______
��8���Ա�ϩΪ��ʼԭ���Ʊ���ͪ�������![]() ���ĺϳ�·�����£��벹�����������Լ���ѡ����_____
���ĺϳ�·�����£��벹�����������Լ���ѡ����_____
![]()
���𰸡����� 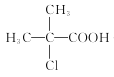 +2NaOH
+2NaOH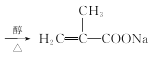 +NaCl+2H2O
+NaCl+2H2O ![]() �ӳɷ�Ӧ
�ӳɷ�Ӧ 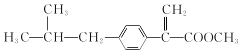
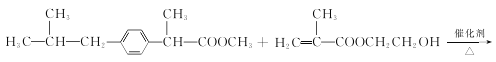
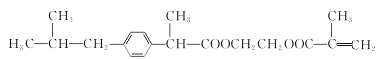 +CH3OH
+CH3OH 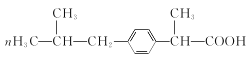 +nHOCH2CH2OH
+nHOCH2CH2OH
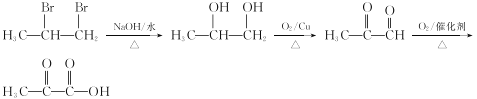
��������
��������ͼ��֪AΪ�춡��(CH3)2CHCOOH��A�ڼ��ȵ���������PCl3 ��Ӧ����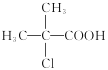 ��J�����Ӿ۷�Ӧ���ɻ��Ͳ���ң��ɻ��Ͳ���ҵĽṹ��ʽ����JΪ
��J�����Ӿ۷�Ӧ���ɻ��Ͳ���ң��ɻ��Ͳ���ҵĽṹ��ʽ����JΪ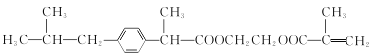 ��
�� ������Ӧ������B��B�ữ����C��C��C2H6O2��Ӧ����D��C2H6O2ΪHOCH2CH2OH����C��DΪ������Ӧ��D�к�������A��SOCl2��Ӧ����E������E��F��G�ķ�Ӧ������E��F��G���������֪�ٵķ�Ӧ������G�ķ���ʽ��A�Ľṹ��ʽ��֪��E�Ľṹ��ʽΪ(CH3)2CHCOCl��F�Ľṹ��ʽΪ
������Ӧ������B��B�ữ����C��C��C2H6O2��Ӧ����D��C2H6O2ΪHOCH2CH2OH����C��DΪ������Ӧ��D�к�������A��SOCl2��Ӧ����E������E��F��G�ķ�Ӧ������E��F��G���������֪�ٵķ�Ӧ������G�ķ���ʽ��A�Ľṹ��ʽ��֪��E�Ľṹ��ʽΪ(CH3)2CHCOCl��F�Ľṹ��ʽΪ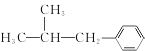 ��XΪ����G�Ľṹ��ʽΪ
��XΪ����G�Ľṹ��ʽΪ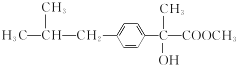 ��G��Ũ���������·�����ȥ��Ӧ����H��H�Ľṹ��ʽΪ
��G��Ũ���������·�����ȥ��Ӧ����H��H�Ľṹ��ʽΪ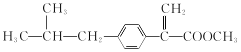 ��H��H2/Ni�����ӳɷ�Ӧ����I��I�Ľṹ��ʽΪ
��H��H2/Ni�����ӳɷ�Ӧ����I��I�Ľṹ��ʽΪ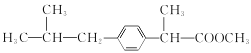 ��I��D��Ӧ����J�����J�Ľṹ��ʽ����֪�ڣ�D�Ľṹ��ʽΪ
��I��D��Ӧ����J�����J�Ľṹ��ʽ����֪�ڣ�D�Ľṹ��ʽΪ![]() ����D��һ�����Ƴ�CΪH2C=C(CH3)COOH��BΪ
����D��һ�����Ƴ�CΪH2C=C(CH3)COOH��BΪ![]() ��
��
��1��A�Ľṹ��ʽΪ(CH3)2CHCOOH�����й������Ȼ�������A�������
��2����Ӧ�� ��
��![]() ����Ӧ����ΪNaOH����Һ�����ȣ���Ӧ����ʽΪ
����Ӧ����ΪNaOH����Һ�����ȣ���Ӧ����ʽΪ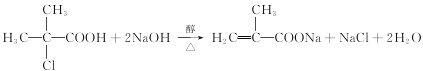 ��
��
��3�������ƶ�XΪ�����ṹ��ʽΪ![]() ��
��
��4��F��GΪ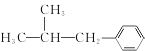 ��
�� ���������������֪�ٵķ�Ӧ�����������ʻ��ļӳɷ�Ӧ��
���������������֪�ٵķ�Ӧ�����������ʻ��ļӳɷ�Ӧ��
��5���ɷ�����֪H�Ľṹ��ʽ�ǣ� ��
��
��6����Ӧ�ڵĻ�ѧ����ʽΪ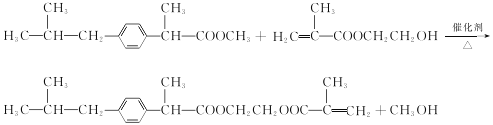 ��
��
��7�����Ͳ�����к����������Ͳ����ˮ��ķ���ʽΪ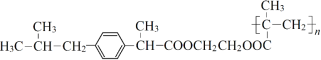 +2nH2O
+2nH2O![]()
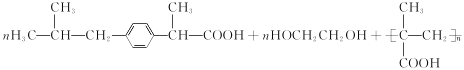 ��
��
��8���Ա�ϩΪ��ʼԭ���Ʊ���ͪ�������![]() ���������Ѹ�����Ӧ�ɱ�ϩ�ϳ�CH3COCOOH���Աȱ�ϩ��CH3COCOOH�ṹ��ʽ���ɺ�̼̼˫�������ʺϳ�˫�����ŵ����ʣ������ɱ�ϩ��Br2/CCl4�����ӳɷ�Ӧ����CH3CHBrCH2Br��CH3CHBrCH2Br����ˮ�ⷴӦ����CH3CH��OH��CH2OH��CH3CH��OH��CH2OH�������������Ƶ�CH3COCOOH���ϳ�·��Ϊ
���������Ѹ�����Ӧ�ɱ�ϩ�ϳ�CH3COCOOH���Աȱ�ϩ��CH3COCOOH�ṹ��ʽ���ɺ�̼̼˫�������ʺϳ�˫�����ŵ����ʣ������ɱ�ϩ��Br2/CCl4�����ӳɷ�Ӧ����CH3CHBrCH2Br��CH3CHBrCH2Br����ˮ�ⷴӦ����CH3CH��OH��CH2OH��CH3CH��OH��CH2OH�������������Ƶ�CH3COCOOH���ϳ�·��Ϊ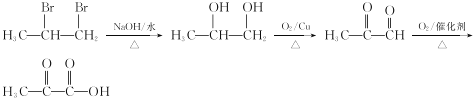 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L�ܱ������г���4mol A�����3mol B���壬�������з�Ӧ��2A(g)+B(g)![]() C(g)+xD(g)��5s�ﵽƽ�⡣�ﵽƽ��ʱ��������1mol C���ⶨD��Ũ��Ϊ2mol/L��
C(g)+xD(g)��5s�ﵽƽ�⡣�ﵽƽ��ʱ��������1mol C���ⶨD��Ũ��Ϊ2mol/L��
(1)��x =____��
(2)�����ʱ��A��ƽ����Ӧ����Ϊ_____ mol��L-1��s-1��
(3)ƽ��ʱB��Ũ��Ϊ______ mol��L-1��
(4)A��ת����Ϊ_________��(ת����a=![]() )
)
(5)5s�ﵽƽ�⣬�����ڻ�������ƽ����Է�����������ʼʱ______![]() ������������С���������������ͬ
������������С���������������ͬ![]() ����������ܶȱ���ʼʱ______��
����������ܶȱ���ʼʱ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ��������ʵ�飬�Լ��黯ѧ��Ӧ�е������仯��
��1��ʵ���з��֣���Ӧ����е��¶����ߣ����е��¶Ƚ��͡��ɴ��ж�����������ķ�Ӧ��__�ȷ�Ӧ��Ba(OH)28H2O��NH4Cl��Ӧʱ����Ҫ��������ϸ��Ŀ����_����Ӧ����__(����������������)�������仯����ͼ��ʾ��

��2��Ϊ����֤Fe3+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ����_(�����)��
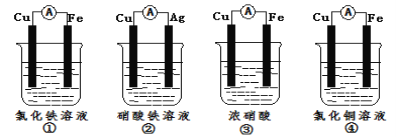
��3����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ����ͼ��ʾ(a��bΪ���̼��)����_(��A��B)���缫���ͨ���飬�����ı���¼���33.6Lʱ����������ת����Ϊ90%��������ת�Ƶ��ӵ����ʵ���Ϊ__mol��

��4����ͼ��ij��ѧ��ȤС��̽����ͬ�����»�ѧ��ת��Ϊ���ܵ�װ�á���ش��������⣺

�ٵ��缫cΪAl���缫dΪCu���������ҺΪϡ����ʱ��д����ԭ��������ĵ缫��ӦʽΪ__��
�ڵ��缫cΪAl���缫dΪMg���������ҺΪ����������Һʱ����ԭ��صĸ�����ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������������ƽ���ƶ�ԭ�����͵���
A. ±����������ת��

B. ����FeCl3��Һ

C. �����ڲ�ͬ������ˮ��

D. ̽��ʯ��ʯ��ϡ�������ܱջ����µķ�Ӧ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ����400mL 0.075molL-1��KMnO4��Һ����2gCu2S��CuS�Ļ����������·�Ӧ�� �� 8MnO4- + 5Cu2S + 44H+ = 10Cu2+ + 5SO2��+ 8Mn2+ + 22H2O�� 6MnO4- + 5CuS + 28H+ = 5Cu2+ + 5SO2��+ 6Mn2+ + 14H2O����Ӧ�������Һ���Ͼ�SO2��ʣ���KMnO4ǡ����350mL 0.1molL-1��(NH4)2Fe(SO4)2��Һ��ȫ��Ӧ����֪�÷�Ӧ�Ļ�ѧ����ʽ���£�2KMnO4+10(NH4)2Fe(SO4)2+8H2SO4=K2SO4+2MnSO4+10(NH4)2SO4+5Fe2(SO4)3+8H2O
��1����Ӧ����������Ϊ____����ԭ��Ϊ_______����������Ϊ___________��
��2����˫���ŷ������Ӧ���ĵ���ת�����____ 6MnO4- + 5CuS + 28H+ = 5Cu2+ + 6Mn2++ 5SO2�� + 14H2O
��3����Ӧ����ÿת��3mol���ӣ������ɱ�״������������Ϊ_________L��
��4��KMnO4��Һ��������ﷴӦ��ʣ��KMnO4�����ʵ���Ϊ ______ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�����������·�����£�
CH2=CH2![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
��ش��������⣺
��1��д����ϩ�ĵ���ʽ_____________________________________��
��2��C2H5OH�� CH3COOH�����еĹ��������Ʒֱ���____________��____________��
��3��д�����з�Ӧ�ķ�Ӧ���ͣ���______________����_____________��
��4����ϩ�ܷ����ۺϷ�Ӧ�������Ľṹ��ʽΪ______________��
��5��д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ�ڣ�__________________________��
��Ӧ�ܣ�___________________________��
��6��ʵ��������ͼװ���Ʊ�����������
���Թ������Ƭ��������______������a��������_______________��
���Թ��б���̼������Һ�������ǣ�________ �� ________ ��
��װ��ͼ����һ�����ԵĴ�����______________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a mol Na2O2��b mol NaHCO3�����Ϻ����ܱ������м��ȵ�250 ����ʹ���ַ�Ӧ�����ų�O2��H2O(g)�����ʵ���֮��Ϊ1��1 ʱ��a��bΪ
A��1��1 B��1��2 C��2��3 D��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��ҺX����K����NH4+��Ba2����Al3����Fe3����CO32-��SO42-�е�������������ɣ�ȡ����Һ��������ʵ�飺

��1����ɫ��������___��
��2������������ʵ���ҵļ��鷽����___��
��3����д��ʵ���������������A��B�����ӷ���ʽ____��___��
��4��ͨ������ʵ�飬��ȷ��X��Һ��һ�����ڵ�������____����δȷ���Ƿ���ڵ�������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A. �����£�0.1 mol/L Na2S��Һ�д��ڣ�c(OH��) = c(H��) + c(HS��) + c(H2S)
B. �����£�pHΪ1��0.1 mol/L HA��Һ��0.1 mol/L NaOH��Һǡ����ȫ��Ӧʱ����Һ��һ�����ڣ� c (Na+) = c(A��) > c(OH��) = c(H+)
C. �����£�pH=7��CH3COONa��CH3COOH�����Һ��c(Na+)=0.1 mol/L��c(Na+) = c(CH3COOH) > c(CH3COO��) > c(H+) = c(OH��)
D. �����£���0.1 mol/L CH3COOH��Һ��ˮϡ�ͣ�����Һ��pH��3.0����4.0ʱ����Һ��![]() ��ֵ��С��ԭ����
��ֵ��С��ԭ����![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com