
【题目】设NA为阿伏加德罗常数的值,下列说法确的是
A. 常温下,22gCO2所含的共用电子对数目为NA
B. 标准状况下,22.4LNO 与11.2LO2混合后气体中分子总数小于NA
C. 将1 L 0.1mol/L FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,1L0.5mol/L NH4Cl溶液与2L0.25mol/L NH4Cl溶液中的NH4+数目相同
【答案】B
【解析】A. CO2分子含有4个共价键即4对共用电子对,22g即0.5molCO2所含的共用电子对数目为2NA,故A错误;B. 标准状况下,22.4L即1molNO与11.2L即0.5molO2混合后,2NO+O2![]() 2NO2,2NO2
2NO2,2NO2![]() N2O4,所得气体中分子总数小于NA,故B正确;C. Fe(OH)3胶粒是许多Fe(OH)3分子的集合体,所以将1L0.1mol/LFeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目小于0.1NA,故C错误;D. 稀释有利于盐类水解,常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液中的NH4+的水解程度,前者小于后者,所以NH4+数目前者大于后者,故D错误。故选B。
N2O4,所得气体中分子总数小于NA,故B正确;C. Fe(OH)3胶粒是许多Fe(OH)3分子的集合体,所以将1L0.1mol/LFeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目小于0.1NA,故C错误;D. 稀释有利于盐类水解,常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液中的NH4+的水解程度,前者小于后者,所以NH4+数目前者大于后者,故D错误。故选B。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌用阴极,镀件作阳极,溶液中含有锌离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
CrO42﹣ ![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
己知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)═Cr2O72﹣(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣ . 下列说法不正确的是( )
A.转化过程中,增大c(H+),平衡向正反应方向移动,CrO42﹣的转化率提高
B.常温下Ksp[Cr(OH)3]=1×10﹣32 , 要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
C.若用绿矾(FeSO47H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
D.常温下转化反应的平衡常数K=104 , 则转化后所得溶液的pH=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 氢氧化铝与盐酸反应:H++OH-=H2O
B. 碳酸钙与稀硝酸反应:CO32-+2H+=H2O+CO2↑
C. 锌与稀硫酸反应:Zn+2H+=Zn2++H2↑
D. 氯化镁溶液与氢氧化钠溶液反应:Mg2++OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A (g)+B (s)![]() C(g); ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”、“ 减慢”或“不变”)。
C(g); ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”、“ 减慢”或“不变”)。
(1)升温____________;
(2)加正催化剂______________;
(3)增大容器容积___________;
(4)加入C_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有____________________。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
ⅰ锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
![]()
① 过程Ⅰ发生反应的化学方程式为______________________(SiO2+3C![]() SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
②整个制备过程必须严格控制无水。SiCl4遇水剧烈水解生成两种酸,反应的化学方程式是_________________________。
ⅱ 工业上也可以通过如下图所示的流程制取纯硅:
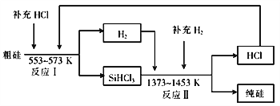
①有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_________;SiHCl3极易水解,其完全水解的化学方程式为___________________________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | ﹣30.4 | ﹣84.9 | ﹣111.9 |
② 假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com