
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).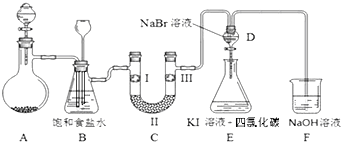
(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为: .
(2)装置B中饱和食盐水的作用是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 .
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D,E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡.观察到的现象是 . 经认真考虑,有同学提出该实验方案仍有不足,请说明其中不足的原因是 .
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式: .
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)除去Cl2中的HCl
(3)d
(4)橙黄,溶液分层,上层接近无色,下层(四氯化碳层)为紫红色,氯气氧化性也强于碘,若通入Cl2过量,可能是过量氯气置换出I2
(5)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)盐酸易挥发,反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;
所以答案是:除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d;
所以答案是:d;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘,则E中碘易溶于四氯化碳,出现溶液分层,上层接近无色,下层(四氯化碳层)为紫红色,该现象不能说明溴的非金属性强于碘,因为氯气氧化性也强于碘,过量的氯气也可将碘离子氧化;
所以答案是:橙黄;溶液分层,上层接近无色,下层(四氯化碳层)为紫红色;
氯气氧化性也强于碘,若通入Cl2过量,可能是过量氯气置换出I2;
(5)氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
所以答案是:Cl2+2NaOH=NaCl+NaClO+H2O.
【考点精析】掌握氯气的实验室制法是解答本题的根本,需要知道实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100mL﹣1).
(1)实验步骤
①用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL(填仪器名称)中定容,摇匀即得待测白醋溶液.
②用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
③读取盛装0.100 0molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为mL.![]()
④滴定.当时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(2)实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
数据处理与讨论
①按实验所得数据,可得c(市售白醋)=molL﹣1(列式计算);市售白醋总酸量=g100mL﹣1(列式计算).
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)短周期元素R,T,Q,W在元素周期表中的相对位置如图所示,其中Q单质可制成半导体材料.下列判断正确的是( ) 
A.W形成的离子半径大于T形成的离子半径
B.W的单质在过量氧气中燃烧生成WO3
C.最高价氧化物的水化物的酸性:R<Q
D.T是地壳中含量最多的金属元素,其单质的化学性质较活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应是吸热反应的是( )
A.C+CO2 ![]() 2CO
2CO
B.Fe+H2SO4═FeSO4+H2↑
C.2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
D.2Na2O2+2H2O═4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.35g二氧化锰能与足量浓盐酸(密度为1.19gcm﹣3、质量分数为36.5%)完全反应.求:
(1)浓盐酸中HCl的物质的量浓度:c(HCl)= .
(2)被氧化的HCl的物质的量:n(HCl)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |

A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的
①钠比水轻 ②钠的熔点较低 ③钠与水反应在时要放出热量 ④钠与水反应后溶液呈碱性
A. ①④ B. ①②④ C. ①③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com