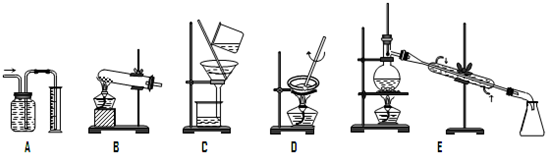
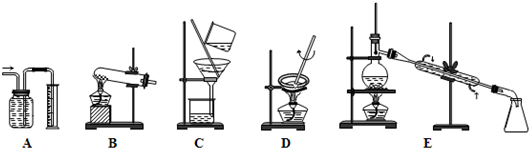
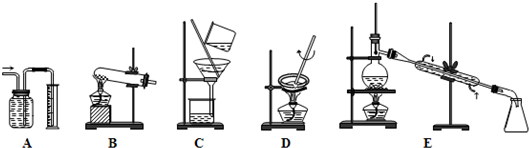
解:Ⅰ(1)①因A装置是量气装置,故答案为:A.
②因C装置是过滤装置,故答案为:C;
③因D装置是蒸发装置,故答案为:D;
④因E装置是蒸馏装置,故答案为:E;
⑤因消石灰与氯化铵共热制NH
3是固体+固体

气体,故答案为:B;
⑥因CCl
4易挥发,可用蒸馏的方法分离出CCl
4,故答案为:E;
(2)常见的物质的分离和提纯的方法:过滤、蒸发、结晶、蒸馏、分液、萃取等,故答案为:CDE;
因萃取和分液都需要分液漏斗,故答案为:萃取或分液.
Ⅱ(1)铝的原子序数是13,失去3个电子生成铝离子,故答案为:
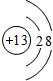
;第三周期第ⅢA族;
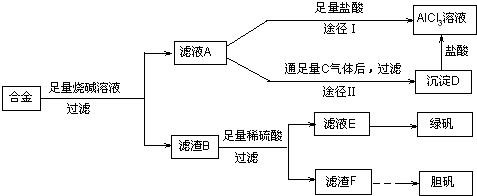
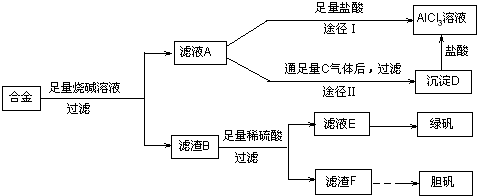
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,故答案为:;途径Ⅱ更合理;因为按途径I直接向A加入盐酸得到的AlCl
3溶液中含有大量的NaCl杂质;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,将析出的固体洗涤、干燥,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶、洗涤、干燥;
(4)铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,硫酸铜溶液是蓝色的,由于各反应物是混合接触在一起的,这两个反应是同时进行的,所以氧化铜没机会单独的存在,故我们可以认为反应物为氧气、铜和硫酸,而生成物为硫酸铜和水,故可以写出该反应的化学方程式,故答案为:;2Cu+O
2+2H
2SO
4=2CuSO
4+2H
2O;
(5)氯化铝为强酸弱碱盐,Al
3+发生水解,水解的方程式为Al
3++3H
2O?Al(OH)
3+3H
+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)
3不稳定,灼烧时分解生成Al
2O
3,故答案为:;AlCl
3+3H
2O?Al(OH)
3+3HCl,加热蒸发时,随HCl的挥发,平衡正向移动而生成Al(OH)
3,灼烧时2Al(OH)
3=Al
2O
3+3H
2O,故得Al
2O
3而非AlCl
3.
分析:Ⅰ(1)根据A装置是量气装置;
根据B装置是固体+固体

气体的装置;
根据C装置是过滤装置;
根据D装置是蒸发装置;
根据E装置是蒸馏装置;
(2)根据常见的物质的分离和提纯的方法:过滤、蒸发、蒸馏、分液、萃取等;根据萃取和分液都需要分液漏斗;
Ⅱ(1)根据铝的原子序数是13确定其在周期表中位置;
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)根据AlCl
3属于强酸弱碱盐,在溶液中存在水解平衡,从平衡移动的角度分析并解答该题.
点评:本题考查物质的分离和提纯,难度较大,注意掌握氯化铝为强酸弱碱盐,Al
3+发生水解,水解的方程式为Al
3++3H
2O?Al(OH)
3+3H
+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)
3不稳定,灼烧时分解生成Al
2O
3.

 气体,故答案为:B;
气体,故答案为:B;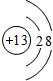 ;第三周期第ⅢA族;
;第三周期第ⅢA族; 气体的装置;
气体的装置;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案