
【题目】按照下图所示的操作步骤,完成氢氧化钠与盐酸的反应的实验。
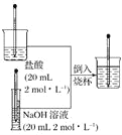
回答下列问题:
(1)反应后混合溶液的温度与反应前盐酸和氢氧化钠溶液的温度相比较其变化是___________________________________。
(2)你认为酸碱中和反应是放热反应还是吸热反应____________________________________。
(3)写出该反应的离子方程式:____________________________________________________。
科目:高中化学 来源: 题型:
【题目】2019年3月21日是第二十七届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100![]() ,进行了三组实验,其操作和有关图像如下图所示,请回答下列问题:
,进行了三组实验,其操作和有关图像如下图所示,请回答下列问题:

(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_______,一定存在的阳离子是_____。
(2)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为_______
(3) 若通过实验确定原废水中c(Na+)=0.14mol/L,试判断原废水中NO3-是否存在?_____(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=______mol/L。(若不存在或不确定则此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程如下:

⑴Na2Cr2O7可由FeO·Cr2O3先氧化、再酸化得到。其中FeO·Cr2O3发生氧化反应的化学方程式为4FeO·Cr2O3+7O2+20NaOH![]() 8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
⑵“调节pH=4”后,溶液中c(Fe3+)=4×10-8 mol·L-1,则该温度下Ksp[Fe(OH)3]=______。
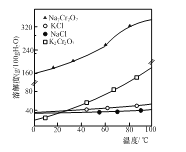
⑶已知部分物质的溶解度曲线如图所示。反应Ⅰ的化学反应类型为______。实验室由质量分数为10%的K2Cr2O7溶液获取K2Cr2O7晶体的方法是______。
⑷为测定K2Cr2O7样品纯度(杂质不参与反应),实验过程为:准确称量一定质量样品,与足量酸性KI 溶液充分反应后,用Na2S2O3标准溶液滴定生成的I2。实验过程中发生的物质转化关系分别为:Cr2O72-![]() Cr3+ S2O32-
Cr3+ S2O32-![]() S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1的硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:
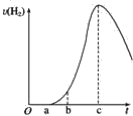
(1)曲线由O→a段不产生氢气的原因是__________________;
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是______________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的步骤如下,请回答相关问题:
![]()
Ⅰ.高锰酸钾的制备
(1)将![]() 和
和![]() 固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入
固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入![]() 粉末,不断搅拌,呈颗粒状后,再加强热
粉末,不断搅拌,呈颗粒状后,再加强热![]() 得墨绿色产物(
得墨绿色产物(![]() 为墨绿色固体),冷却。
为墨绿色固体),冷却。
①制![]() 反应的化学方程式为____。
反应的化学方程式为____。
②实验中使用的坩埚及搅拌棒的材质可以是________。
A.石英 B.瓷 C.刚玉(氧化铝) D.铁
(2)取出墨绿色产物研细,每次用![]() 4%的热
4%的热![]() 溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
(3)![]() 在水溶液中会发生歧化反应:
在水溶液中会发生歧化反应:![]() ,通入
,通入![]() 气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入
气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入![]() 气体至溶液
气体至溶液![]() 在10~11之间,过滤。滤液中的溶质除
在10~11之间,过滤。滤液中的溶质除![]() 外,还主要含有_____。
外,还主要含有_____。
(4)将滤液转入蒸发皿,小火加热,当看到________的现象时停止加热,冷却,________、________,干燥后得![]() 粗品。
粗品。

Ⅱ.高锰酸钾纯度的测定
(5)称取![]() 粗品,加入煮沸并冷却后的稀硫酸配成
粗品,加入煮沸并冷却后的稀硫酸配成![]() 溶液。量取
溶液。量取![]() 的草酸(
的草酸(![]() )溶液于锥形瓶中,用所配
)溶液于锥形瓶中,用所配![]() 溶液进行滴定。重复滴定两次,平均消耗
溶液进行滴定。重复滴定两次,平均消耗![]() 溶液的体积为
溶液的体积为![]() 。
。
①滴定开始时,溶液颜色褪去较慢,随后加快,原因是________。
②滴定终点的标志是___________。
③![]() 纯度(质量分数)的计算式为________。
纯度(质量分数)的计算式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 ℃时,将0.100 mol的N2O4气体充入1 L 抽空的密闭容器中,发生如下反应:N2O4![]() 2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
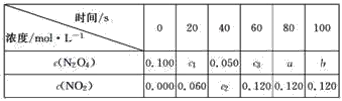
(1)达到平衡时,N2O4的转化率为______________,表中c2________c3,a________b(填“>”、“<”或“=”)。
(2)20 s时N2O4的浓度c1=________ mol·L-1,在0~20 s内N2O4的平均反应速率为________ mol·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,则要达到上述同样的平衡状态,二氧化氮的起始浓度是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是
A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,H2S 的 Ka1 =1.0 ×10-7,Ka2 =1.0 ×10-15下列说法正确的是
A.0.1 mol L-1的 NaHS溶液中:c(S2ˉ)>c(H2S)
B.反应 S2ˉ+ H2O ![]() HSˉ+ OHˉ 的平衡常数 K=1×10-7
HSˉ+ OHˉ 的平衡常数 K=1×10-7
C.NaHS与 Na2S以任意比混合的溶液中 :c( Na+)+ c(H+)=c(HSˉ)+ c(S2ˉ)+c(OHˉ)
D.0.1 mol L-1的Na2S 溶液中:c(OHˉ)= c(H+)+ c(HSˉ) + 2c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以秸秆为原料制备某种聚酯高分子化合物的合成路线:
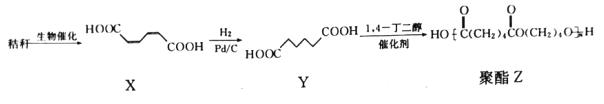
下列有关说法正确的是
A.X的化学式为C4H6O4
B.Y分子中有1个手性碳原子
C.生成聚酯Z的反应类型为加聚反应
D.制备聚酯Z,消耗Y和1,4-丁二醇的物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com