
化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是
A.在食品袋中放入盛有硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
B.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏
C.白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g酒精
D.回收废弃塑料制成燃油或回收地沟油制生物柴油,可减轻环境污染和节约化石能
科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列有关化学用语的表示方法中正确的是( )
A.氯元素的原子结构示意图: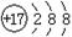 B.N2的结构式:N≡N
B.N2的结构式:N≡N
C.原子核内有8个中子的氧原子: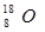 D.二氧化碳的电子式:
D.二氧化碳的电子式: 
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:填空题
(14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性 。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。
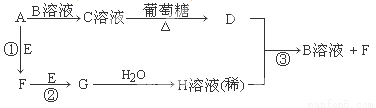
请回答下列问题:
(1)A分子是 分子(填“极性”或“非极性”),C溶液中的阳离子是 (写化学式,不考虑水的电离)。
(2)反应①的化学方程式为 ;反应③的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
下列推论正确的是:
A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2
B.C(石墨,s)=C(金刚石,S)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ
D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH—)=2c(H+)+c(HA)-c(A—)
B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2—)+c(HR—)=c(Na+)
D.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH一定为14-a
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是
A.pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1 :10
B.1.0mol/ L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:
c(Na+)>c(CH3COO-) >c(OH-)>c(H+)
D.0.1mol/ L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/ L
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:填空题
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)  CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市万州区高三考前模拟理综化学化学试卷(解析版) 题型:选择题
某小分子抗癌药物的分子结构如图所示,下列说法正确的是
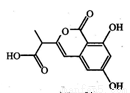
A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:实验题
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com