
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2→X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3↓
试回答下列问题:
(1) W、X、Y、Z的化学式分别是:W:________,X:________,Y:________,Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:______________________________________________。
②化学方程式:________________________________________________。
【答案】NaHCO3 Na2CO3 NaOH Na2O2 ②③ Na2O2 Ca2++CO32-=CaCO3↓ Ca(OH)2+K2CO3=2KOH+CaCO3↓(合理即可)
【解析】
四种钠的化合物,Z能与二氧化碳、水反应生成氧气,故Z为Na2O2,X为Na2CO3,Y为NaOH,W分解生成碳酸钠、二氧化碳与水,故W为NaHCO3,据此解答。
(1)根据框图所示的内容,钠的化合物中,受热能分解生成三种产物的是碳酸氢钠,所以W是碳酸氢钠,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,所以X是碳酸钠,能和二氧化碳以及水反应生成氧气的是过氧化钠,所以Z是过氧化钠,则W、X、Y、Z的化学式分别为NaHCO3、Na2CO3、NaOH、Na2O2;
(2)以上4个化学反应中,反应②:2Na2O2+2CO2=2Na2CO3+O2和③:2Na2O2+2H2O=4NaOH+O2↑中有元素化合价的变化,属于氧化还原反应,两个反应中化合价变化的均是过氧化钠中的氧元素,所以Na2O2既是氧化剂又是还原剂;
(3)碳酸钠和氢氧化钙反应的离子方程式为:CO32-+Ca2+=CaCO3↓,此外该离子反应还可以表示氢氧化钙溶液和碳酸钾溶液之间的反应等,即Ca(OH)2+K2CO3=2KOH+CaCO3↓。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A. 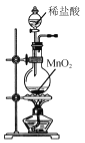 制取Cl2
制取Cl2
B. 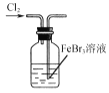 使Br-转化为Br2
使Br-转化为Br2
C. 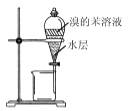 分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液
D.  将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器中盛有适量的A和B的混合气体,在一定条件下发生反应,A(g) +3 B(g)![]() 2C(g)若维持温度和压强不变,达到平衡时,容器的体积为V L。其中C气体的体积占20%,下列推断正确的是
2C(g)若维持温度和压强不变,达到平衡时,容器的体积为V L。其中C气体的体积占20%,下列推断正确的是
①原混合气体的体积为1.1V L ②原混合气体的体积为1.2V L
③反应达平衡时气体B消耗掉0.1V L ④反应达平衡时气体A消耗掉0.1V L
A. ②③B. ②④C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池发电站,与普通火力发电站相比,其有害物排放少,运行噪音低,被誉为“绿色”发电站。如图为某空气燃料电池工作原理,下列说法错误的是
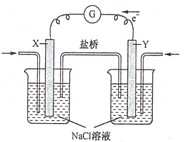
A.该电池工作时,X电极附近的溶液pH升高
B.该电池工作时,盐桥中的阴离子向Y电极移动
C.若用甲醇作燃料,则X电极上的反应为CH3OH-6e-+H2O=CO2+6H+
D.若用甲烷作燃料,当电路中通过0.8mol电子时,则消耗甲烷的质量为1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
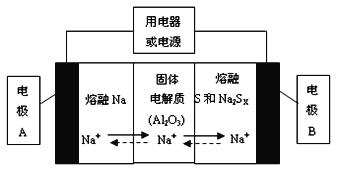
①根据上右表数据,请你判断该电池工作的适宜应控制在_________(填字母)范围内。
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100~300℃ c.300~350℃ d.350~2050℃
②放电时,电极A为_________极,电极B发生_________反应(填“氧化或还原”)
③充电时,总反应为Na2SX=2Na+xS(3<x<5),则阳极的电极反应式为:________________。
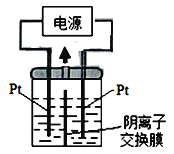
(2)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:___________;试分析左侧溶液蓝色逐渐变浅的可能原因是:___________。
(3)若把钠硫电池作为电源,按如图所示装置进行实验电解乙池和丙池:
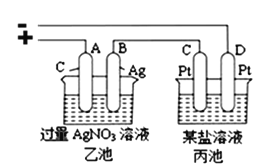
当钠硫电池中消耗0.05xmol的S时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“C”或“D”)电极析出7.20g金属,则丙装置中的某盐溶液可能是_______(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是( )
①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOH
A.①③B.①④⑤C.②④⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
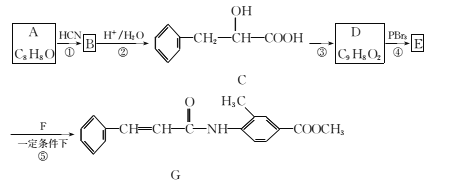
【题目】某新型药物G合成路线如图所示:
已知:Ⅰ.RCHO![]()
![]() (R为烃基);
(R为烃基);
Ⅱ.RCOOH![]()
![]() ;
;
Ⅲ. ![]() +RNH2
+RNH2![]()
![]()
请回答下列问题:
(1)A的名称为 ___,合成路线图中反应③所加的试剂和反应条件分别是______。
(2)下列有关说法正确的是 __(填字母代号)。
A. 反应①的反应类型为取代反应
B. C可以发生的反应类型有取代、加成、消去、加聚
C. D中所有碳原子可能在同一平面上
D. 一定条件下1 mol G可以和2 mol NaOH或者9 mol H2反应
(3)F的结构简式为____。
(4)C在一定条件下可以发生聚合反应生成高分子化合物,写出该反应的化学方程式 ______。
(5)D有多种同分异构体,同时满足下列条件的同分异构体有 ___种。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)参照G的上述合成路线,设计一条由乙醛和H2NCH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)及其化合物在化学工业中有诸多用途,请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B的化合价为_______________。
②工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4反应的另种产物为甲醇钠(CH3ONa),该反应的化学方程式为______________________。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为____________________。
(2)工业上以铁硼矿(主要成分为Mg2B2O5H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
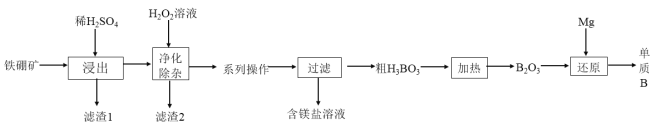
已知:相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 5.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 8.8 | 11 |
请回答下列问题:
①“浸出”时.将铁硼矿石粉碎的目的为___________________________。写出Mg2B2O5H2O与硫酸反应的化学方程式:____________________。
②滤渣1的主要成分为_____________________________。
③“净化除杂”时需先加H2O2溶液,其目的为_______________,然后再调节溶液的pH≈5,其目的是___________________________________。
④制得的粗硼在一定条件下能生成BI3 , BI3加热分解可以得到纯净的单质硼。现将0.025 g粗硼制成的BI3完全分解,生成的I2用0.30 molL-1 Na2S2O3溶液滴定(I2 +2S2O32-=2I-+ S4O6 2-)至终点,消耗 18.00 mLNa2S2O3溶液:盛装Na2S2O3溶液应用_____________填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g) ![]() C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
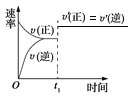
A. ②③B. ①②C. ③④D. ④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com