
【题目】比较下列各组物质的沸点 ( )
①乙醇>丙烷 ②正丁烷>异丁烷 ③1-丁烯>1-庚烯,其中正确的是
A. ①③B. ①②C. ②③D. ①②③
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )

A. 该反应的化学方程式为3X+Y![]() 2Z
2Z
B. 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态
C. 平衡时,体系的压强是开始时的1.8倍
D. 平衡时,Y的体积分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.淀粉可以制得葡萄糖和酒精
B.铝合金的熔点和硬度均高于纯铝
C.玻璃、塑料、金属、纸类均是可回收的物品
D.硬化油不易被空气氧化而便于储存和运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_____________,电子排布式_____________________。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),形成的单质为______晶体。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。_____
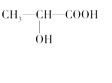
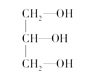
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; HClO3________HClO4; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为______杂化,VSEPR构型为__________,分子的立体构型为__________________。
②BF3分子中,中心原子的杂化方式为________杂化,分子的立体构型为____________。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸铵的电离:CH3COONH4![]() CH3COO-+NH4+
CH3COO-+NH4+
C. 氯化银的溶解平衡表达式:AgCl(s) ![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
D. 汽车尾气净化反应2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,请参照①~⑨在表中的位置,回答下列问题:

(1)②的元素符号是__________,⑥在周期表中的位置是___________。
(2)⑦、⑧两元素比较,非金属性强的是(填元素符号)_______,从原子结构角度解释原因_________。
(3)④-⑥这三种元素中,写出最高价氧化物对应水化物两两之间能反应的离子方程式____________________。
(4)写出工业冶炼元素⑤单质的化学方程式_________,不选择热还原法冶炼这种活泼金属的原因是___________________。
(5)元素①和③可以组成很多种物质,写出其中原子个数比为1:4的物质的电子式______,请从化学键角度解释该物质中原子个数比为1:4的原因________________。
(6)已知Se在周期表中的位置如图所示,请画出Se的原子结构示意图________。
请任意写出三种Se物质的化学式,预测其性质(一条即可),并说明预测依据,完成在下列表格中。________
含Se物质化学式 | 性质 | 预测依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2mol NO2,发生下列反应2NO2(g) ![]() N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
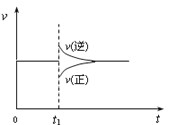
A.保持压强不变,升高反应温度
B.保持温度和容器体积不变,充入1mol N2(g)
C.保持温度和容器体积不变,充入1mol N2O4 (g)
D.保持温度和压强不变,充入1mol N2O4 (g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com