
【题目】在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
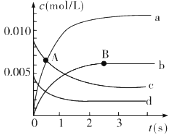
反应过程如图所示,其中只有3条曲线是正确的。请回答:
(1)A点处,v(正)____v(逆) (填“大于”“小于”或“等于”,下同),A点正反应速率_______B点正反应速率。
(2)图中表示NO2的变化的曲线是___。用O2表示从0~2 s内该反应的平均速率v=__。
(3)能说明该反应已经达到平衡状态的是________ (填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.减小O2的浓度 d.选择高效的催化剂
【答案】> > b 0.0015 mol/(L·min) bc bd
【解析】
(1)化学反应正向进行,正反应速率大于逆反应速率;逆向进行,正反应速率小于逆反应速率;
(2)根据一氧化氮的平衡浓度仪器变化浓度计算氧气的平衡浓度,根据公式v=![]() 计算化学反应速率;
计算化学反应速率;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)一般增大反应物的浓度、增大压强,升高温度、使用催化剂,化学反应速率加快,以此来解答。
(1)根据反应中,一氧化氮的浓度逐渐减小可知:该反应是正向进行建立平衡的,所以A点正反应速率大于逆反应速率;随着反应的进行,反应物的浓度减小,反应速率减慢,A点费用正向进行,B点反应达到平衡状态,所以A点速率大于B点速率;
(2)反应中NO的浓度变化量△c(NO)=![]() =0.0065mol/L,所以O2的浓度减小量是0.00375mol/L,根据方程式的系数关系可知NO2浓度变化量△c(NO2)=△c(NO)= 0.0065mol/L,所以图中表示NO2的变化的曲线是b曲线,从0~2s内用NO浓度变化表示反应速率为v(NO)=
=0.0065mol/L,所以O2的浓度减小量是0.00375mol/L,根据方程式的系数关系可知NO2浓度变化量△c(NO2)=△c(NO)= 0.0065mol/L,所以图中表示NO2的变化的曲线是b曲线,从0~2s内用NO浓度变化表示反应速率为v(NO)=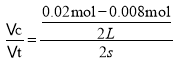 =0.003mol/(Ls);由于v(NO):v(O2)=2:1,所以v(O2)=
=0.003mol/(Ls);由于v(NO):v(O2)=2:1,所以v(O2)=![]() v(NO)= 0.0015 mol/(L·min);
v(NO)= 0.0015 mol/(L·min);
(3) b.在任何时刻都存在速率关系v(NO)=2v(O2),所以不能据此判断正逆反应速率相等,反应不一定平衡,a错误;
b.反应在恒容密闭容器内进行,由于反应前后气体的物质的量不相等,若容器内压强保持不变,说明气体的物质的量不变,反应达到平衡状态,b正确;
c.在任何时刻都存在速率关系v(NO)正=2v正(O2),若v逆(NO)=2v正(O2),则v(NO)正= v逆(NO),反应处于平衡状态,c正确;
d.反应前后气体的质量不变,容器的容积不变,因此无论反应是否处于平衡状态,容器内的密度保持不变,故不能据此判断反应处于平衡状态,d错误;
故合理选项是bc;
(4)a.及时分离出NO2气体,会使物质的浓度降低,因此会降低反应速率,a错误;
b.适当升高温度,物质的内能增加,分子之间的有效碰撞次数增加,反应速率加快,b正确;c.减小O2的浓度,物质单位体积内有效碰撞次数减小,反应速率降低,c错误;
d.选择高效的催化剂可以大大加快反应速率,d正确;
故合理选项是bd。


科目:高中化学 来源: 题型:
【题目】x、y、z、w、n为五种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
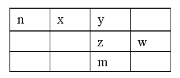
请回答下列问题:
(1)w位于周期表中第__________周期,第__________族。
(2)n、z、w、三种元素最高价氧化物水化物的酸性由弱到强的顺序为:__________(用化学式表示)。
(3)下列事实能说明y元素的非金属性比z元素的非金属性强的是____
A.y单质与z的气态氢化物水溶液反应,溶液变浑浊
B.在氧化还原反应中,1moly单质比1molz得电子多
C.y和z两元素的简单氢化物受热分解,前者的分解温度高
D.y元素最高价氧化物水化物酸性比z元素最高价氧化物水化物酸性强
(4)y和氢元素形成的10电子微粒中常见![]() 价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见
价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见![]() 价阴离子的电子式为__________。
价阴离子的电子式为__________。
(5)化合物nyz存在于天然气中,可以用NaOH溶液洗涤除去。化合物nyz的电子式为__________,其与NaOH溶液反应除生成两种正盐外,还有水生成,其化学方程式为__________。
(6)m元素的原子序数为__________,它是一种__________。(填“金属”或“非金属”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Cl、SO42、SO32、HCO3、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验,下列说法不正确的是

A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物N具有镇痛、消炎等药理作用,其合成路线如下:

(1)A的系统命名为____________,E中官能团的名称为____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为____________。
(5)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(6)M的结构简式为____________。
(7)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。

该路线中试剂与条件1为____________,X的结构简式为____________;
试剂与条件2为____________,Y的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池的正极的反应式_________。
(2)由 Mg、Al和氢氧化钠溶液组成的原电池中,负极的反应式 ________。当在电极上产生气体3.36L(标准状况)时,导线中通过的电子电子数目为_____个(用 NA表示阿伏加德罗常数的值)。
(3)日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池结构如下图所示,据此回答下列问题:
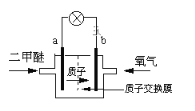
a极为电池的____极,b电极上的电极反应式为____。电池工作时电流的方向是由_______(填“a”或“b”, 下同)经导向______。电池工作时,若有0.1mol二甲醚被氧化时,有_______mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
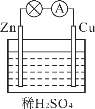
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn极:Zn-2e-= Zn2+ ④Cu极:Cu2++2e-= Cu
A. ①②B. ①③C. ①②③D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com