
分析 (1)根据有化合价降低的反应物为氧化剂判断;
(2)根据反应时有沉淀、气体、颜色变化等明显现象选择试剂;
(3)选择试剂时要考虑:既能使NaNO2转化又无二次污染;
(4)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,结合电荷守恒、原子守恒配平其它物质的系数;根据电子转移守恒计算生成氮气的物质的量,再根据V=nVm计算氮气的体积.
解答 解:(1)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,所以NaNO2是氧化剂,
故答案为:NaNO2;
(2)①水、③淀粉、④白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,
故答案为:②⑤;
(3)NaNO2→N2是被还原,必须加还原剂;N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂.方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,
故答案为:B;
(4)反应中Al→NaAlO2,Al元素化合价由0价升高为+3价,共升高3价,NaNO3→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由钠原子守恒可知NaOH系数为4,由H元素守恒可知H2O前面的系数为2,故配平后离子方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,故答案为:10;6;4;10;3;2.
点评 本题考查氧化还原反应的配平、计算、基本概念等,难度不大,注意对基础知识的理解掌握.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 11:3 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子的大小在1nm~1000nm之间 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | 明矾在水中能生成氢氧化铝胶体,故可作净水剂 | |
| D. | 用光束照射CuSO4溶液不能观察到丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
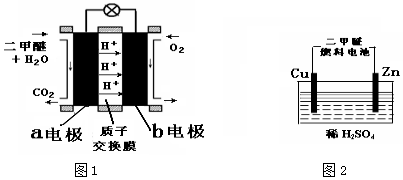
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com