
【题目】已知海水中的溴含量约为65mg·L-1,从海水中提取溴的工业流程如图:
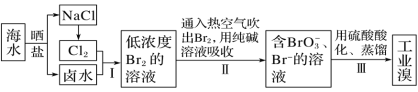
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的______(填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数,并将配平后的反应写在答题纸相应位置。_____
![]()
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为_____。
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有______(填字母)。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
【答案】富集(或浓缩)溴元素 C 3,3,1,5,3 Br2+SO2+H2O=2Br-+![]() +4H+ BD
+4H+ BD
【解析】
根据流程,海水晒盐后得到卤水和氯化钠,电解氯化钠溶液可以得到氯气,氯气将卤水中Br-氧化为Br2,得到低浓度的溴水,利用溴的挥发性,使用热空气吹出Br2用纯碱吸收,得到含有![]() 和Br-的混合液,加入硫酸提供酸性环境,发生归中反应得到高浓度的溴水,蒸馏得到工业溴。通过步骤Ⅱ和Ⅲ使较低浓度的溴水变为高浓度溴水起到富集作用,从而降低直接蒸馏提纯的成本,据此分析解答。
和Br-的混合液,加入硫酸提供酸性环境,发生归中反应得到高浓度的溴水,蒸馏得到工业溴。通过步骤Ⅱ和Ⅲ使较低浓度的溴水变为高浓度溴水起到富集作用,从而降低直接蒸馏提纯的成本,据此分析解答。
(1)步骤Ⅰ中已获得游离态的溴浓度很低,如果直接蒸馏,生产成本较高,不利于工业生产,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素,降低成本,故答案为:富集溴元素;
(2)溴易挥发,步骤Ⅱ通入热空气或水蒸气吹出Br2,就是利用溴的挥发性,故答案为:C;
(3)该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为:3Br2+3![]() =
=![]() +5Br-+3CO2↑,故答案为:3,3,1,5,3;
+5Br-+3CO2↑,故答案为:3,3,1,5,3;
(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的离子方程式为:Br2+SO2+H2O=2Br-+![]() +4H+,故答案为:Br2+SO2+H2O=2Br-+
+4H+,故答案为:Br2+SO2+H2O=2Br-+![]() +4H+;
+4H+;
(5)萃取剂的选取标准:萃取剂和溶质不反应、溶质在萃取剂中的溶解度大于在原溶剂中的溶解度、萃取剂和原溶剂不互溶。
A.乙醇易溶于水,所以不能作萃取剂,故A正确;
B.四氯化碳符合萃取剂选取标准,所以能作萃取剂,故B正确;
C.裂化汽油中含有烯烃,可与溴发生加成反应,不能做萃取剂,故C错误;
D.苯符合萃取剂选取标准,所以能作萃取剂,故D正确;
故选BD。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是旧的化学键断裂会_____能量;新的化学键形成会_____能量。(填“放出”或“吸收”)
(2)用铝热法可冶炼铁,其反应为:Fe2O3+2Al![]() 2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
(3)为探究反应过程中的能量变化,某小组同学用如图装置进行实验。
|
|
装置Ⅰ | 装置Ⅱ |
①装置Ⅰ中,Fe与CuSO4溶液反应的离子方程式是_____。
②装置Ⅱ中,正极的电极反应式为______。
③关于装置Ⅱ,下列叙述正确的是______(填字母)。
a.H+在Cu表面被还原,产生气泡
b.电流从Zn片经导线流向Cu片
c.电子从Zn片经导线流向Cu片
d.Zn和Cu的都是电极材料,也都参与电极反应
(4)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是_____。
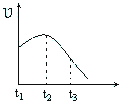
A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因水蒸发,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行镁条的质量下降
D.从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A. CH3COOH溶液中加入少量CH3COONa固体,溶液的pH值升高
B. 浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)- c(CH3COOH)=2[c(H+)-c(OH-)]
C. 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/ c(H+)减小
D. 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
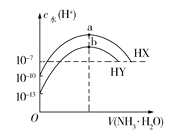
A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )

A.该装置将太阳能直接转化为化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )

A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com