
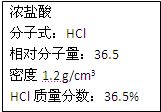
 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.2×36.5% |
| 36.5 |
| 0.14mol |
| 0.25L |
| 5.3g |
| 106g/mol |
| 1000ρw |
| M |
| 1000×1.2×36.5% |
| 36.5 |
| x | ||
|


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2010年重庆市西南师大附中高一上学期期中考试化学试卷 题型:实验题
右图为实验室某浓盐酸试剂瓶上的标签,试 根据有关数据回答下列问题:
根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目  D.溶液的密度
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500 mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L;向所得混合溶液中加入5.3 g Na2CO3固体,充分反应后,溶液中生成沉淀的质量有_________g。
(5)在标准状况下,将______________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得盐酸的密度为1.2 g/cm3,溶质质量分数为36.5% 。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源:河南省10-11学年高一第一次月考(化学) 题型:填空题
(8分)右图为实验室某浓盐酸试剂瓶标签上的有关数据,根据有关数据回答下列问题:
|
盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g/m3 质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量不随所取体积多少 而变化的是 。
A、溶液中HCl的质量 B、溶液的p H
C、溶液中H+的数目 D、溶液的密度
(3)欲配制上述浓盐酸,需要在1L水中通入标态下 L
HCl气体(保留1位小数)
(4)现有1L1mol/L的稀盐酸,欲使其浓度增大1倍,采取的措施合理的是 。
A、通入标况下HCl气体22.4L B、将溶液加热浓缩至0.5L
C、加入5mol/L的盐酸0.6L,再稀释至2L。 D、加入1L 3mol/L的盐酸混合均匀。
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高一上学期期中考试化学试卷 题型:填空题
(10分,每空2分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。
A.用量筒量取浓盐酸时俯视观察凹液面
B.摇匀后,液面下降,补充水
C.定容时仰视刻度线
D.在配制前用相同浓度的稀盐酸润洗容量瓶
(2)现将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L。
(3)在标准状况下,将_____________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得溶质质量分数为36.5%的盐酸。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三上学期第一次月考化学试题 题型:填空题
(7分)试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为 。
(2)把1 molNa和1mol
Mg分别投入到过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为

(3)右图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答
下列问题:

①该浓盐酸中HCl的物质的量浓度为 mol/L。
②标准状况下,1.00L水(密度:1.00g·cm-3)吸收 L的HCl可制得上述浓盐酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com