
| A、0.1 mol?L-1的醋酸的pH=a,0.01 mol?L-1的醋酸的pH=b,则a+1=b |
| B、用200 mL 4 mol?L-1的NaOH溶液将0.6 mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
| C、难溶电解质AB2的饱和溶液中,c(A2+)=xmol?L-1,c(B-)=y mol?L-1,则Ksp值为4xy2 |
| D、常温下0.1 mol?L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol?L-1 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,该溶液一定是钠盐 |
| C、通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- |
| D、加入NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,则原溶液一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
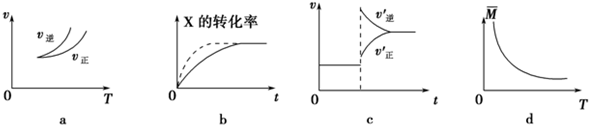
| A、依据图a可判断正反应为吸热反应 |
| B、在图b中,虚线可表示压强增大 |
| C、若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D、由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中加入固体NaOH,则:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、25℃时,稀释0.5 mol?L-1的NH4Cl溶液,水解平衡右移,溶液的PH减小 |
| C、常温下,pH=11的碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性 |
| D、测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、③④⑤ |
| C、②④⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、② | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2体积SO2和足量O2反应,必定生成2体积SO3 |
| B、其他条件不变,增大压强,平衡必定向右移动 |
| C、平衡时,SO2消耗速率必定等于O2的生成速率 |
| D、平衡时,SO2浓度必定等于O2浓度的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+的电子排布式:1s22s22p63s2 |
B、NH4Cl的电子式: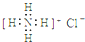 |
| C、乙烯的结构简式:C2H4 |
| D、氨气的空间结构:三角锥形 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com