
【题目】将6.54g氧化铜与石墨的混合粉末隔绝空气加热,充分反应后,生成的气体用足量的NaOH溶液吸收,溶液增重1.32g。则原混合粉末中氧化铜的质量可能是
A.2.4gB.4.8gC.6gD.6.18g
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气与氢气在催化剂表面发生合成氨反应的微粒变化历程如图所示。
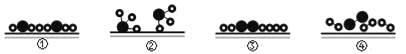
下列关于反应历程的先后顺序排列正确的是( )
A.④③①②B.③④①②C.③④②①D.④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤的干馏产品之一煤焦油中可分离出蒽(![]() ),再经升华提纯得到的高纯度蒽可用作闪烁计数器的闪烁剂。下列关于蒽的说法错误的是
),再经升华提纯得到的高纯度蒽可用作闪烁计数器的闪烁剂。下列关于蒽的说法错误的是
A. 化学式为C14H10
B. 一定条件下能发生取代、加成、氧化等反应
C. 具有12种二氯代物
D. 与菲( )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A________,B________,C________,D________。
(2)写出C2B2的电子式:________
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)用电子式表示化合物C2D的形成过程:_____________________________________。
(5)A与D的最高价氧化物对应的水化物的浓溶液反应的化学方程式为:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
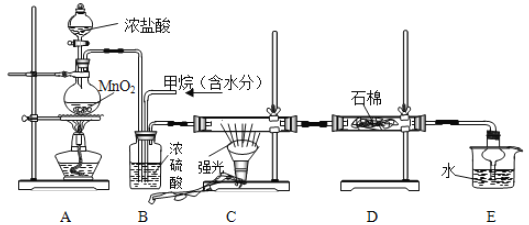
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:___________。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有___溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A分液法 B蒸馏法 C结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为_____,生成HCl的物质的量共为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语回答下列问题
(1)画出钾原子的原子结构示意图:____________。
(2)写出氨分子的结构式:__________________。
(3)用电子式表示氟化钙(CaF2)的形成过程:_________________。
(4)完成下表
K层为最外层时,最多能容纳的电子数 | _________ |
除K层外,其他各层为最外层时,最多能容纳的电子数 | _________ |
次外层最多能容纳的电子数 | _________ |
倒数第3层最多能容纳的电子数 | _________ |
第n层里最多能容纳的电子数 | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为了探究铝与盐酸反应过程中的速率变化,分两组做了以下实验。
(1)甲小组同学用足量的铝与50 mL盐酸发生反应,并用排水集气法收集反应放出的氢气,实验记录如下:
时间/min | 1 | 2 | 3 | 4 | 5 | 反应结束时 |
氢气体积/mL(标准状况下) | 50 | 150 | 300 | 380 | 410 | 560 |
①哪一时间段(即0~1、1~2、2~3、3~4、4~5 min)反应速率最大__,原因是____;
②反应进行到10 min时,便不再有气泡产生,该盐酸中HCl的物质的量浓度是__,整个反应过程中HCl的反应速率为____;
(2)乙小组学生也做了同样的实验,但由于反应太快,不好测量氢气体积,他事先在盐酸中加入等体积的下列液体:A.蒸馏水、B.KCl溶液、C.KNO3溶液、D.CuSO4溶液,以减慢反应速率,你认为可行的是____,不可行的理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图转化关系判断下列说法不正确的是(反应条件已略去)
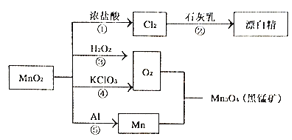
A. 反应①②③④⑤均属于氧化还原反应
B. 生成黑锰矿的反应中,3molMn参加反应转移4mol电子
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应⑤为铝热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com