
| A. | 9 mol | B. | 7 mol | C. | 6 mol | D. | 8 mol |
分析 100g 36.5%的浓盐酸中n(HCl)=$\frac{100g×36.5%}{36.5g/mol}$=1mol,n(H2O)=$\frac{100g×(1-36.5%)}{18g/mol}$=3.53mol,根据“析出什么加入什么”知,电解过程中析出的物质相当于HCl、H2O,阴极上只生成氢气,根据氢气和转移电子之间的关系式计算转移电子物质的量.
解答 解:100g 36.5%的浓盐酸中n(HCl)=$\frac{100g×36.5%}{36.5g/mol}$=1mol,n(H2O)=$\frac{100g×(1-36.5%)}{18g/mol}$=3.5mol,根据“析出什么加入什么”知,电解过程中析出的物质相当于HCl、H2O,阴极上只生成氢气,根据H原子守恒得生成n(H2)=$\frac{1}{2}$n(HCl)+n(H2O)=$\frac{1}{2}$×1mol+3.5mol=4mol,则转移电子物质的量=2n(H2)=2×4mol=8mol,故选D.
点评 本题以电解原理为载体考查物质的量有关计算,为高频考点,明确各个电极上发生的反应是解本题关键,利用原子守恒、关系式即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 6 g石墨中的C-C键数目 | |
| B. | 常温常压下,17 g ND3中所含分子数目 | |
| C. | 向含0.2 mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1 mol羟基(-OH)中所含电子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
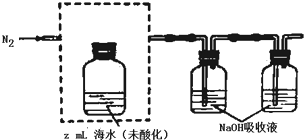
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molAl3+离子含有的核外电子数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5NA个 | |
| D. | 标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2不溶于水,也不溶于酸和碱 | B. | SiO2是制造太阳能电池的常用材料 | ||
| C. | 硅是地壳中含量最多的非金属元素 | D. | 水玻璃可用作木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
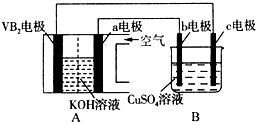 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
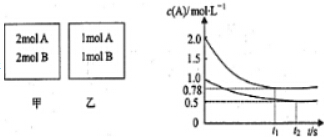
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com