
分析 (1)碳酸氢钠加热分解生成碳酸钠;
(2)Al与NaOH溶液反应,而Mg不能;
(3)氧化铝与NaOH溶液反应,而氧化铁不能,以此来解答.
解答 解:(1)除去Na2CO3粉末中混入的NaHCO3杂质用加热的方法,发生的化学反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)除去Mg粉中混有的少量Al杂质的试剂是NaOH溶液,发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)除去Fe2O3中混有的Al2O3杂质的试剂是NaOH溶液,发生的离子反应为Al2O3+2OH-=2AlO2-+H2O,
故答案为:NaOH溶液;Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 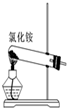 实验室用如图装置制取氨气 | |
| B. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| C. | 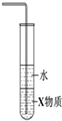 如图装置中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. | 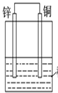 如图装置是原电池,锌电极为负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
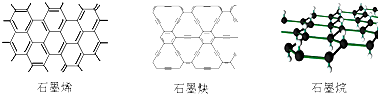
| A. | 石墨烯、石墨炔和石墨烷互为同素异形体 | |
| B. | 12g石墨烯完全转变为石墨烷需氢气11.2L | |
| C. | 石墨炔可作半导体材料,有望替代二氧化硅 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
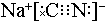 ,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.
,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
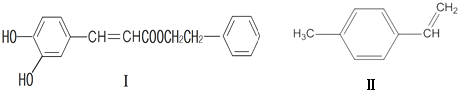
 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.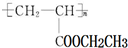 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
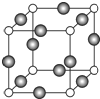 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 mol | B. | 7 mol | C. | 6 mol | D. | 8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com