
| 10-13 |
| 10-11 |
| 10-13 |
| 10-10 |
| 0.01mol/L��aL-0.01mol/L��bL |
| (a+b)L |


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢ� | B���٢ڢ� |
| C���ܢݢ� | D���ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaCl |
| B��Na |
| C��CaO |
| D��Ca�� ClO��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��C+2H2SO4��Ũ��=CO2��+2SO2��+2H2O |
| B��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O |
| C��Na2CO3+H2SO4=Na2SO4+CO2��+H2O |
| D��Cu+2H2SO4��Ũ��=CuSO4+SO2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����屿�� |
| B�������ʵ��ʽ��CH2O |
| C����� |
D���������ĵ���ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����¶ȡ�ѹǿһ���������£��ʱ���ر乲ͬ����һ����ѧ��Ӧ�ķ��� |
| B���¶ȡ�ѹǿһ��ʱ�����ȵ������ӷ�Ӧһ�������Է����� |
| C���ʱ��Ǿ�����Ӧ�ܷ��Է����е�Ψһ���� |
| D��������ܽ�����ز��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��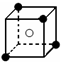 |
B�� |
C��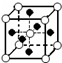 |
D��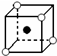 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com