
【题目】下列物质中属于电解质的是:属于非电解质的是 . 能导电的是 . ①CO2 ②NaOH 固体 ③NaHCO3固体 ④C12H22O11(蔗糖) ⑤H2SO4溶液 ⑥铁.
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Si有导电性,可用于制备光导纤维
B. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
C. 硅胶常用作实验室和食品、药品等的干燥剂,也可作催化剂载体
D. 小苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);

(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、“不相等”),
所求中和热 (填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
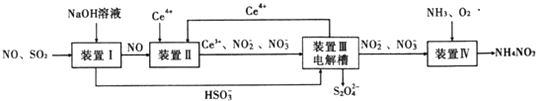
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示

①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。

图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA
B.1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA
C.2.0g H218O与D2O的混合物中所含中子数为NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3﹣物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是

A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7
B.25℃时,0.2mol/L Ba(OH)2 溶液和0.2 mol/L HC1溶液等体积混合,所得溶液的pH等于7
C.25℃时,0.2 mol/L NaOH溶液与 0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH大于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1个硫原子的质童是a g,l个l2C原子的质童是bg,用NA表示阿伏加德罗常数的值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ;
;
②m g该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNAg
④a g该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
三硫化四磷是黄绿色针状结晶,其结构如图所示.不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机济剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为_______。
(2)第一电离能:S____(填“>”或“<”,下同)P,电负性:S____P
(3)三硫化四磷分子中P原子采取______杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属______(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______,用NA表示阿伏伽德罗常数的数值,NaOH的密度为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

己知:
I.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式;
II. CeO2不溶于稀硫酸;利用有机溶剂可分离稀土元素如Ce等化合物。
请按要求回答下列问题:
(1)Ce的原子序数为58,它位于元素周期表中第______周期。
(2)步骤①、⑥反应的化学方程式分别为_________________、______________。
(3)检验滤渣B洗涤干净的方法是____________________。
(4)步骤③的离子方程式为____________________。
(5)操作X名称为_________________。
(6)在滤液B中加过量铁粉于50 °C水浴中加热充分反应后趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集得产品绿矾。
步骤②中的硫酸溶液过稀会导致____________;静置冷却一段时间后,在试管中观察到的现象是______________________。
(7)取2.08 g产品Ce(OH)4加过量稀硫酸溶解后,用0.1000 mol/L FeSO4溶液滴定至终点共消耗90.00mL,则产品中Ce(OH)4的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com