
【题目】
(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);

(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、“不相等”),
所求中和热 (填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
【答案】(1)保温防止热量损失。 (2)偏小 (3)环形玻璃棒;△H>-57.3KJ/mol
(4)不相等、相等 (5)偏小
(6)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3KJ/mol
【解析】(1)在实验中应该尽可能的减少热量的损失,所以烧杯间填满泡沫塑料的作用是保温防止热量损失。
(2)大烧杯上若不盖硬纸板,则会造成热量的损失,测定结果偏低。
(3)根据仪器的结构可知,应该是是环形玻璃棒。由于酸能和氢氧化钠反应放出热量,所以造成氢氧化钠溶液的起始温度高,因此导致最终放出的热量偏少,则△H>-57.3KJ/mol。
(4)改变酸和碱的用量,反应中放出的热量会变化,但反应热是不变的,因为中和热是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关。
(5)氨水是弱电解质,存在电离平衡,电离吸热,所以测得的中和热的数值偏小。
(6)根据中和热的概念可知,热化学方程式为1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3KJ/mol。


科目:高中化学 来源: 题型:
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为A l3+的单体形态铝(用Ala表示)总浓度,主要为主要为[AlO4 Al12(OH)24(H2O)12 ]7+的中等聚合形态铝总浓度(用Alb 表示)和Al(OH)3胶体形态铝(用A1c表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=akJ·mol-1
②3AlCl(g)= 2Al(s)+AlCl3(g) △H2=bkJ·mol-1
则反应Al2O3(s)+33C(s)= 2Al(s)+ 3CO(g)△H=______kJ·mol-1(用含a、b的代数式表尔)。 反应①在常压、1900 ℃ 的高温下才能进行,说明△H______( 填“>”“=”或“<”)。
(1)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如下表:
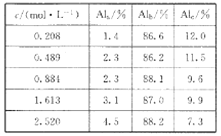
①在一定温度下,c越大,Al(OH)3胶体的百分含量______(填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氯化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_____________。
(3)一定条件下,向1.0mol/L的AlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86 % 的聚合氯化铝溶液。写出生成[AlO4 Al12(OH)24(H2O)12 ]7+的离子方程式:_______。
(4)已知Al3++4X=2![]() ,X表示显色剂,
,X表示显色剂, ![]() 表示有色物质,通过比色分析得到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194mol·L-1)。
表示有色物质,通过比色分析得到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194mol·L-1)。

①1min时, ![]() 的浓度为___________。
的浓度为___________。
②0~3min内该反应的速率vx=________。
③第9min时,反应达到平衡,K=__________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
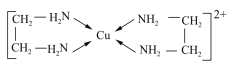
【题目】GaN、GaP、GaAs是人工合成的一系列新型半导体材料,其晶体结构均与金刚石相似。铜是重要的过渡元素,能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。回答下列问题:
(1)基态Ga原子价电子的轨道表达式为________________;
(2)熔点:GaN_____GaP(填“>”或“<”);
(3)第一电离能:As_____Se(填“>”或“<”);
(4)Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是______;
a.配位键 b.极性键 c.离子键 d.非极性键
(5)乙二胺分子中氮原子轨道的杂化类型为________,乙二胺和三甲胺[N(CH3)3]均属于胺。但乙二胺比三甲胺的沸点高很多,原因是___________;
(6)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,铜原子的半径为rcm。该晶体中铜原子的堆积方式为_______型(填“A1”、“A2”或“A3”),该晶体密度为____g/cm3(用含a和NA的代数式表达),该晶体中铜原子的空间利用率为______(用含a和r的代数式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+![]() O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
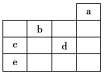
A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 ①乙烯 ②苯 ③乙醇 ④乙酸 ⑤葡萄糖等有机物的叙述不正确的是
A.可以用新制的Cu(OH)2悬浊液鉴别③④⑤
B.只有①③⑤能使酸性KMnO4溶液褪色
C.只有②③④能发生取代反应
D.一定条件下,⑤可以转化为③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中属于电解质的是:属于非电解质的是 . 能导电的是 . ①CO2 ②NaOH 固体 ③NaHCO3固体 ④C12H22O11(蔗糖) ⑤H2SO4溶液 ⑥铁.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
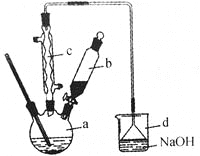
苯 | 溴 | 溴苯 | |
密度/g﹒cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须要做的是 (填入正确操作前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com