
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
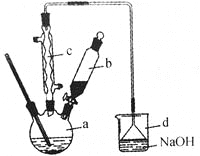
苯 | 溴 | 溴苯 | |
密度/g﹒cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须要做的是 (填入正确操作前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】
(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);

(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、“不相等”),
所求中和热 (填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1个硫原子的质童是a g,l个l2C原子的质童是bg,用NA表示阿伏加德罗常数的值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ;
;
②m g该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNAg
④a g该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
三硫化四磷是黄绿色针状结晶,其结构如图所示.不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机济剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为_______。
(2)第一电离能:S____(填“>”或“<”,下同)P,电负性:S____P
(3)三硫化四磷分子中P原子采取______杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属______(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______,用NA表示阿伏伽德罗常数的数值,NaOH的密度为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期A、B、C、D四种元素,它们的原子序数依次增大,A元素形成的-2价阴离子比氦原子的核外电子数多8个;B元素与A元素可组成一种淡黄色固体E;C的最高价氧化物既可以与酸反应,也可以和碱反应;D元素原子的M层上有7个电子。
(1)C元素的名称 ________;D的气态氢化物与H2S相比,稳定性较强的是_______(用化学式表示);
(2)A、B、C、D三种元素形成的简单离子半径由大到小的顺序为___________________(用化学式表示);
(3)A的常见氢化物中有两种,其中含有18个电子的分子的电子式为是______________。
(4)用电子式表示化合物B2A的形成过程__________________________。
(5)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出K2A2与CO2发生反应的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A. CH3OCH3(g)+3H2O(g) ![]() 6H2(g) + 2CO2(g): △H>0
6H2(g) + 2CO2(g): △H>0

B. CH3COOH![]() H++CH3COO-
H++CH3COO-
C. FeCl3+3KSCN![]() Fe(SCN)3+3KCl
Fe(SCN)3+3KCl

D. N2(g) +3H2(g)![]() 2NH3(g)
2NH3(g)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

己知:
I.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式;
II. CeO2不溶于稀硫酸;利用有机溶剂可分离稀土元素如Ce等化合物。
请按要求回答下列问题:
(1)Ce的原子序数为58,它位于元素周期表中第______周期。
(2)步骤①、⑥反应的化学方程式分别为_________________、______________。
(3)检验滤渣B洗涤干净的方法是____________________。
(4)步骤③的离子方程式为____________________。
(5)操作X名称为_________________。
(6)在滤液B中加过量铁粉于50 °C水浴中加热充分反应后趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集得产品绿矾。
步骤②中的硫酸溶液过稀会导致____________;静置冷却一段时间后,在试管中观察到的现象是______________________。
(7)取2.08 g产品Ce(OH)4加过量稀硫酸溶解后,用0.1000 mol/L FeSO4溶液滴定至终点共消耗90.00mL,则产品中Ce(OH)4的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com