
【题目】书写化学方程式:
(1)乙醛的银镜反应___________________
(2)1-溴丙烷的消去反应_______
(3)乙醇的催化氧化反应_______________________
(4)制取聚乙二酸乙二酯的反应方程式____________
【答案】CH3CHO+2[Ag(NH3)2]OH ![]() CH3COONH4+2Ag↓+3NH3+H2O CH3CH2CH2Br+NaOH
CH3COONH4+2Ag↓+3NH3+H2O CH3CH2CH2Br+NaOH ![]() CH3CH=CH2↑+NaBr+H2O 2CH3CH2OH+O2
CH3CH=CH2↑+NaBr+H2O 2CH3CH2OH+O2 ![]() 2 CH3CHO+2H2O n HOOCCOOH + n HOCH2CH2OH
2 CH3CHO+2H2O n HOOCCOOH + n HOCH2CH2OH ![]() HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O
HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O
【解析】
(1) 乙醛发生银镜反应是醛基的还原性被弱氧化剂氧化为乙酸,发生了氧化反应;
(2) 1-溴丙烷在NaOH醇溶液中发生消去反应生成丙烯;
(3)乙醇催化氧化生成乙醛;
(4) 乙二酸和乙二醇缩聚生成聚乙二酸乙二酯。
(1) 乙醛发生银镜反应是醛基的还原性被弱氧化剂氧化为乙酸,发生了氧化反应,反应的化学方程式为:CH3CHO+2[Ag(NH3)2]OH ![]() CH3COONH4+2Ag↓+3NH3+H2O ,
CH3COONH4+2Ag↓+3NH3+H2O ,
因此,本题正确答案是:CH3CHO+2[Ag(NH3)2]OH ![]() CH3COONH4+2Ag↓+3NH3+H2O ;
CH3COONH4+2Ag↓+3NH3+H2O ;
(2) 1-溴丙烷在NaOH醇溶液中发生消去反应生成丙烯,反应为CH3CH2CH2Br+NaOH![]() CH3CH=CH2↑+NaBr+H2O,
CH3CH=CH2↑+NaBr+H2O,
因此,本题正确答案是:CH3CH2CH2Br+NaOH ![]() CH3CH=CH2↑+NaBr+H2O;
CH3CH=CH2↑+NaBr+H2O;
(3)乙醇催化氧化生成乙醛,反应为2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,
2CH3CHO+2H2O,
因此,本题正确答案是:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(4) 乙二酸和乙二醇缩聚生成聚乙二酸乙二酯,反应为n HOOCCOOH + nHOCH2CH2OH ![]() HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O,
HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O,
因此,本题正确答案是:n HOOCCOOH + n HOCH2CH2OH ![]() HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O。
HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】按照要求将相应序号填入空白中:
A.O2和O3
B.35Cl和37Cl
C.CH3CH2CH3和CH3CH2CH2CH3
D.H2和D2
E.CH3CH2CH2OH和CH3-O-CH2CH3
F.![]() C和
C和![]() N
N
(1)组两种微粒互为同位素___;
(2)组两种物质互为同素异形体___;
(3)组两种物质属于同系物___;
(4)组两物质互为同分异构体___;
(5)组两物质是同一物质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )

A.元素对应的离子半径:Z>X>R>W
B.简单氢化物的沸点:W>R>Y>Z
C.M、N、R、W的简单离子均能促进水的电离
D.Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
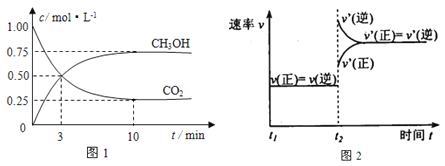
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为_______,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为_______(保留两位小数),若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正)_____v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于1L的密闭容器中,混合后发生如下反应:![]() 。若经2s后测得C的浓度为1.2mol/L,则下列说法正确的是( )
。若经2s后测得C的浓度为1.2mol/L,则下列说法正确的是( )
A.用物质A表示的反应速率为![]()
B.用物质B表示的反应速率为![]()
C.2s内物质A的转化率为30%
D.2s时物质B的浓度为0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四种装置的叙述不正确的是( )
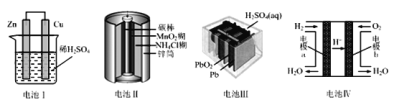
A.电池Ⅰ:正极发生的反应为2H++2e﹣═H2↑
B.电池Ⅱ:锌筒做负极,发生氧化反应
C.电池Ⅲ:是最早使用的充电电池,又称为二次电池
D.电池Ⅳ:外电路中电子由电极b通过导线流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质的分子式都是C7H8O,若滴入FeCl3溶液,只有C呈紫色。若投入金属钠,只有B没有变化。
(1)若C的分子中苯环上的原子团处于邻位,写出A、B、C的结构简式:
A____________,B____________,C_____________ 。
(2)C的另外两种同分异构体的结构简式是:①__________,②________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是_______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1:4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2![]() _______+2H2O
_______+2H2O
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3:1
d.CO2的生成速率与CH3OH的生成速率相等
现测得CO2相CH3OH (g)的浓度随时间变化如图所示。
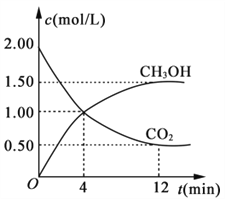
从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2 CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
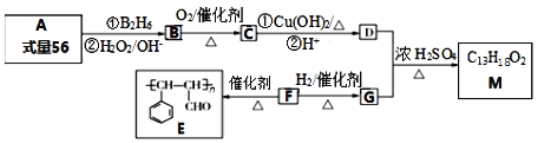
已知:(1)A是含一个支链的烃;
(2)R-CH=CH2 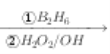 R-CH2CH2OH。
R-CH2CH2OH。
请回答下列问题:
(1)有机物A的系统命名为_______________。
(2)F中官能团的名称为:______________;F与新制的氢氧化铜悬浊液反应的化学方程式:________。
(3)D+G→ M的反应方程式为_____________。
(4)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体。X中满足与FeCl3溶液反应显紫色,其核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1:1:2:6的结构简式为_________。
(5)参照M的合成路线,设计一条由丙烯为起始原料制备丙酸丙酯的合成路线无机试剂任选)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com