
����Ŀ������������Դ����ǿ��������������̼�ŷţ�ʵʩ��̼�����ǽ�������������ش��������⣺
(1)���д�ʩ��������Ч���ٶ�����̼����_______������ĸ����
a��ֲ�����֣�����ɭ�֣�����ֲ��
b���Ӵ��ú��ʯ�͵Ŀ��ɣ�������ʹ��Һ��ʯ����
c��������չ���ܡ�ˮ������ϫ�ܷ���ͺ˵磬��������̫���ܵ��ۺϿ���
d���ƹ�ʹ�ý��ܵƺͽ��ܵ�����ʹ�ÿյ�ʱ�ļ��¶Ȳ������ù��ͣ����첻�˹���
(2)��ѧ�������ڶ�����̼�ġ����ת���������о����罫CO2��H2��1:4�����ʵ���֮�Ȼ��ͨ�뷴Ӧ�������ʵ������·�Ӧ�ɻ��һ����Ҫ��Դ����������»�ѧ����ʽ��
CO2+4H2![]() _______+2H2O
_______+2H2O
(3)��CO2�ϳ�ȼ�ϼ״�(CH3OH)��̼���ŵ��·����ֽ�������ʵ�飺ij�¶��������Ϊ1L���ܱ������У�����2 mol CO2��6 mol H2��������Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�����жϸ÷�Ӧ�Ѵﻯѧƽ��ı�־��____������ĸ����
CH3OH(g)+H2O(g)�����жϸ÷�Ӧ�Ѵﻯѧƽ��ı�־��____������ĸ����
a��CO2�ٷֺ������ֲ���
b�������л��������������ֲ���
c��������H2Ũ����CO2Ũ��֮��Ϊ3:1
d��CO2������������CH3OH�������������
�ֲ��CO2��CH3OH (g)��Ũ����ʱ��仯��ͼ��ʾ��
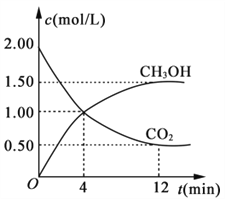
�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=________��
(4)��KOHΪ����ʵļ״�ȼ�ϵ���ܷ�ӦΪ2CH3OH+3O2+4KOH=2K2 CO3+6H2O��ͨ��״��ĵ缫Ϊȼ�ϵ�ص�______�����������������������ӦʽΪ________________��
���𰸡� b CH4 ad 0.375 mol/(L��min) �� O2+2H2O+4e-=4OH-
��������(1) ֲ����������ǿ�������,�������Ķ�����̼,����������, a�������Ӵ�ú��ʯ�ͻ����������ӻ�ʯȼ�ϵ�ʹ��,�����˶�����̼���ŷ�, b��ȷ�������ƽ����ܡ����ܡ���ϫ�ܽ���,��������̫���ܵ��ۺϿ����ܼ��ٶ�����̼���ŷ�,����������, c�������ƹ�ʹ�ý��ܵƺͽ��ܵ���,ʹ�ÿյ�ʱ�ļ��¶Ȳ������ù���,���첻�˹���,�ܼ��ٵ��ʹ��,����ú��ʯ�ͻ�ʯȼ�ϵ�ʹ��,���ٶ�����̼���ŷ�,����������, d��������ȷѡ��b��
(2)���������غ㶨�ɣ���Ӧǰ��ԭ�ӵ�����Ŀ���ֲ��䣬����1molCO2 ��4molH2ǡ����ȫ�ַ�Ӧ����2molH2O�⣬��������1mol CH4����ȷ�𰸣�CH4��
(3) ��һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬����CO2�ٷֺ������ֲ������˵����Ӧ�ﵽƽ��״̬��a��ȷ�����������غ㶨�ɿ�֪�����л�����������ʼ�ձ��ֲ��䣬����˵���ﵽƽ��״̬��b����ƽ��ʱŨ�Ȳ��ٷ����仯���������ʵ�Ũ��֮�䲻һ����Ȼ�����ij�ֹ�ϵ�����������H2Ũ����CO2Ũ��֮��Ϊ3:1����˵����Ӧ�ﵽƽ��״̬��c������CO2����������CH3OH��������������㷴Ӧ����֮������Ӧ�Ļ�ѧ������֮�ȣ��ҷ�Ӧ�������෴�ģ���˿���˵���ﵽƽ��״̬��d��ȷ��adѡ����ȷ������ͼ���֪��Ӧ���е�12minʱ�ﵽƽ��״̬����ʱ���ɼ״���Ũ����1.5mol/L�����Ը��ݷ���ʽ��֪����������Ũ����1.5mol/L��3��4.5mol/L������������ʾ�ķ�Ӧ����Ϊ4.5mol/L��12min��0.375 mol/��L��min������ȷ����ad ��0.375 mol/(L��min)��
(4) �״�ȼ�ϵ�أ��״��ڸ�������������Ӧ������������������ԭ��Ӧ��������ӦʽΪO2+2H2O+4e-=4OH-����ȷ�𰸣�����O2+2H2O+4e-=4OH-��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����÷�Һ©�����з�����ǣ�������
A. ʳ�κ�ˮ B. ������Ȼ�̼ C. ���ͺ�ú�� D. ˮ�����Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������л�ѧ����ʽ����������Ӧ����.
��1��CH4+Cl2![]() _______________��______________��
_______________��______________��
��2��CH2=CH2+Br2��_______________��______________��
��3��![]() _______________��______________��
_______________��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������������������Ʒ���ʯ�����ϣ���CO2���建��ͨ�����еĹ��������ϣ����ܿ�ȼ��������ʵ�������֪�����б��ﲻ��ȷ������ ��
A. ��Ӧ���ɵ�O2��������ȼ�� B. ����������CO2��Ӧ����
C. CO2����ȼ������ȼ���� D. ����������CO2��Ӧ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����һ���¶��£�������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ�����б�������ȷ���ǣ� �� 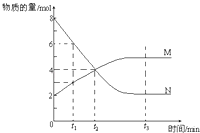
A.��Ӧ�Ļ�ѧ����ʽΪ��2 NM
B.t2ʱ�����淴Ӧ������ȣ��ﵽƽ��
C.t3ʱ������Ӧ���ʴ����淴Ӧ����
D.t1ʱ��N��Ũ����MŨ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɽ��ʯ(TiO2)��ȡ����Ti�漰�IJ���Ϊ��TiO2��TiCl4![]()
��֪����C(s)+O2(g)=CO2(g) ��H1=-393.5kJ��mol-1
��2CO(g)+O2(g)=2CO2(g) ��H2=-566 kJ��mol-1
��TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ��H3=+141 kJ��mol-1
��TiO2(s) +2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)�ġ�H��
A. -80 kJ��mol-1 B. -160 kJ��mol-1 C. +160 kJ��mol-1 D. +80kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������µ��ܱ������У�4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H=-905.9 kJ��mol-1������������ȷ����
4NO(g)+6H2O(g) ��H=-905.9 kJ��mol-1������������ȷ����
A. ƽ��������¶ȣ����������NO��������
B. ƽ���ѹǿ���������ƽ��Ħ����������
C. 4molNH3��5molO2��Ӧ���ﵽƽ��ʱ�ų�����Ϊ905.9kJ
D. ƽ��ʱ����ˮ�����Ƴ����֣���ʱ�淴Ӧ���ʽ��ͣ�����Ӧ���ʲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ I���� Fe2���� SO2�� Cl���� H2O2���л�ԭ�ԣ�������������Һ�л�ԭ��ǿ��˳��Ϊ
Cl��<Fe2��<H2O2<I��<SO2�������з�Ӧ���ܷ�������( )
A. 2Fe2����Cl2===2Fe3����2Cl��
B. 2Fe3����SO2��2H2O===2Fe2����SO42����4H��
C. SO2��I2��2H2O===H2SO4��2HI
D. H2O2��H2SO4===SO2����O2����2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com